No hay productos en el carrito.
Pseudotrombocitopenia
Pseudotrombocitopenia inducida por ácido etilendiaminotetraacetico (EDTA)
Antecedentes de la Pseudotrombocitopenia
La Pseudotrombocitopenia dependiente de ETDA (PT-EDTA) la describió en 1969 Glowland como una falsa trombocitopenia asociada con anticuerpos anti-plaquetas de tipo IgG activados por EDTA, los mismos que reconocen los receptores glicoproteinicos de Gpllb-llla y estimulan la activación plaquetaria mediante la sobreexpresión de antígenos como GMP1 40 GP55 y la trombospondina, activando la vía tirosina cinasa y finalmente causando aglutinación in vitro de plaquetas.
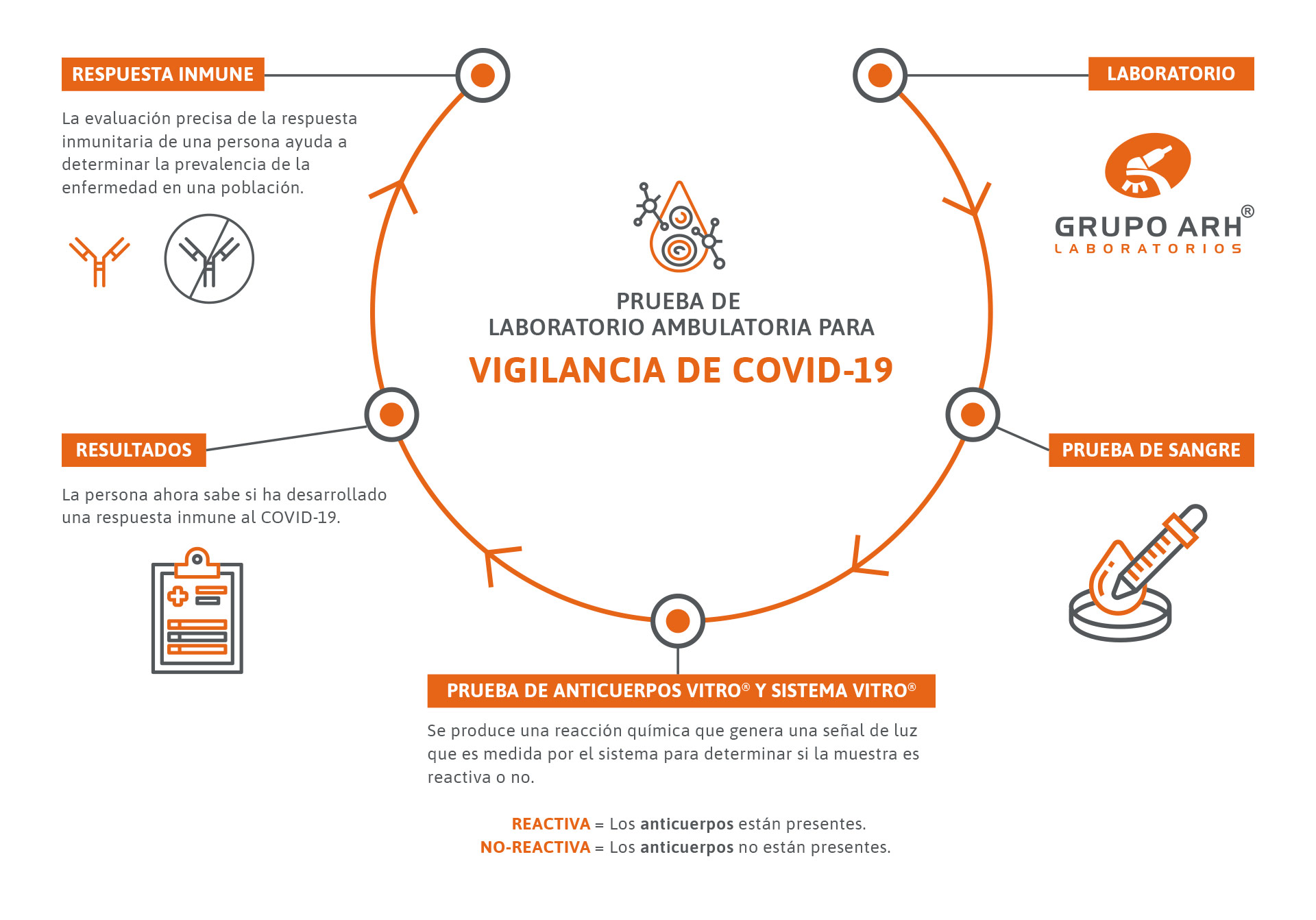
Prueba de anticuerpos COVID-19
Anticuerpos totales (IgG, IgA, IgM) y Anticuerpos IgG para Coronavirus 2019 (SARS-CoV2) “cuantificados”
En Grupo ARH Laboratorios estamos comprometidos ayudándole a manejar esta pandemia con resultados en los que puede confiar.
Por qué importa la precisión
Una prueba de anticuerpos contra COVID-19 debe ser precisa para que los anticuerpos contra otros virus como el resfriado común no se puedan confundir con anticuerpos contra COVID-19. Esto asegura que no haya “falsos positivos” – que la prueba no se volverá reactiva a ningún otro anticuerpo. Esto se garantiza al tener una especificidad del 100%.
La capacidad de evaluar con mayor precisión a los que tienen anticuerpos ayuda a informar las decisiones de salud pública. Permite una vigilancia precisa de la prevalencia de la enfermedad en una población.
Las pruebas de anticuerpos pueden ayudar a los investigadores a comprender cuánto tiempo permanecen en el cuerpo los anticuerpos contra el SARS-CoV-2 y determinar la relación entre la respuesta inmune y la inmunidad al virus.
Las pruebas de anticuerpos COVID-19 en Grupo ARH Laboratorios, brindan confianza en los resultados a través del diseño del ensayo y la tecnología VITROS®.
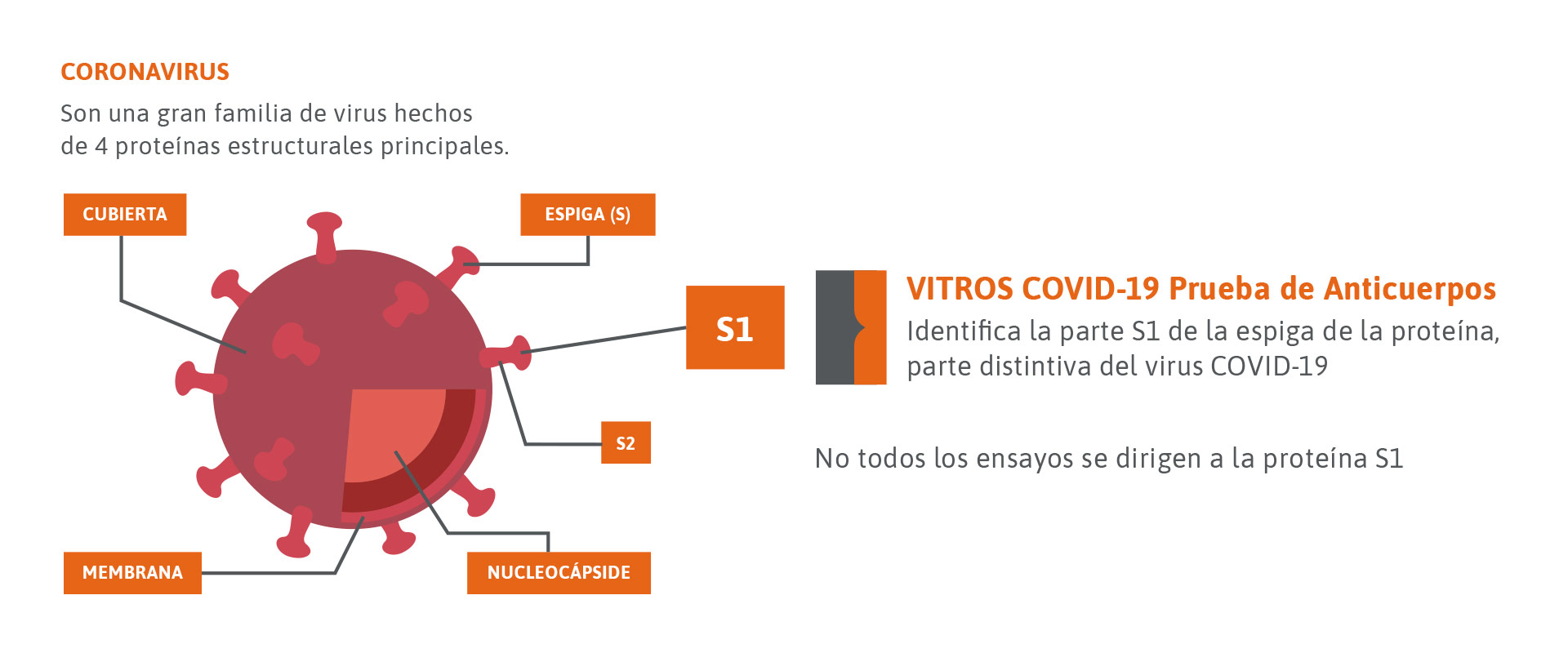
*Apuntando a la proteína S1
Los coronavirus comparten similitudes estructurales y están formados por 4 proteínas clave. Al capturar el antígeno S1, la más singular de estas 4 proteínas, esta prueba minimiza el riesgo de falsos positivos o identifica a alguien con una respuesta inmune al virus cuando no la tiene.
Las pruebas de anticuerpos de Ortho se pueden utilizar en un entorno hospitalario como parte de la gestión de la atención al paciente. Las pruebas también se pueden utilizar en un entorno de atención ambulatoria para ayudar a determinar la prevalencia de la enfermedad en una población.
Anemia por deficiencia de hierro
La anemia por deficiencia de hierro es la anemia más común entre la población, especialmente en mujeres y personas con enfermedades crónico-degenerativas como la diabetes mellitus, los síntomas más prevalentes son cansancio, palidez, dolor de cabeza, mareos, debilidad y fatiga aunque en ocasiones no causa síntomas por eso es muy importante checarse.
Y recuerda una alimentación equilibrada, ejercicio y chequeo periodico ayudan a mejorar tu calidad de vida.
Determinación de albúmina y creatinina en orina
La detección y cuantificación adecuada de la proteinuria es de gran importancia en el manejo de pacientes con enfermedad renal. La albuminuria se reconoce como el marcador más temprano de enfermedad glomerular y se asocia con la hipertensión, la obesidad y la enfermedad vascular. La microalbuminuria puede progresar a proteinuria franca llevando a un 10 a 20% de los pacientes a enfermedad renal de estadio terminal, requiriendo diálisis o transplante renal y el riesgo de muerte se incrementa significativamente.
El cociente Albúmina/Creatinina proporciona información importante en la detección temprana y monitoreo del daño renal, las mediciones repetidas del cociente evita el sobrediagnóstico debido a cambios transitorios de la albuminuria, es una prueba funcional y fiable utilizando la primera orina de la mañana.
La Vasculitis
La vasculitis es una inflamación de los vasos sanguíneos. Ocurre cuando el sistema inmunitario del cuerpo ataca a los vasos sanguíneos por equivocación. Puede ocurrir por una infección, una medicina u otra enfermedad.
Signos y síntomas: Fiebre, Sudoraciones nocturnas, astenia, pérdida de peso, artritis, síntomas neurológico, dolor abdominal
Prueba de laboratorio: Ac. Anti Citoplasma Neutrófilo (C-ANCA Y P-ANCA)
Utilidad: apoyo para el diagnóstico de las siguientes las enfermedades asociadas son granulomatosis eosinófila con poliangeítis, granulomatosis con poliangeitis
Granulomatosis con poliianfeítis asociada a inmunoglobulina A, Poliangeítis microscópica vasculitis cutánea de pequeños vasos, glomerulonefritis anti-membrana basal, colangitis esclerosante primaria y enfermedades intestinales inflamatoria crónica (principalmente colitis ulcerosa)
La determinación de anticuerpos anticitoplasma de neutrófilo (ANCAS), ha revolucionado en el diagnóstico en la vasculitis. Distinguiéndose en dos tipos de ANCAS: Un patrón citoplasmático que representa anticuerpos frente a la proteinasa 3 de los neutrófilos, los cuales son altamente sensibles y específicos para granulomatosis de wegener y un segundo patrón, el perinuclear que representa los anticuerpos contra la mieloperoxidasa de los neutrófilos que se ha relacionado con poliangeitis microscópica síndrome de pulmón, riñón.
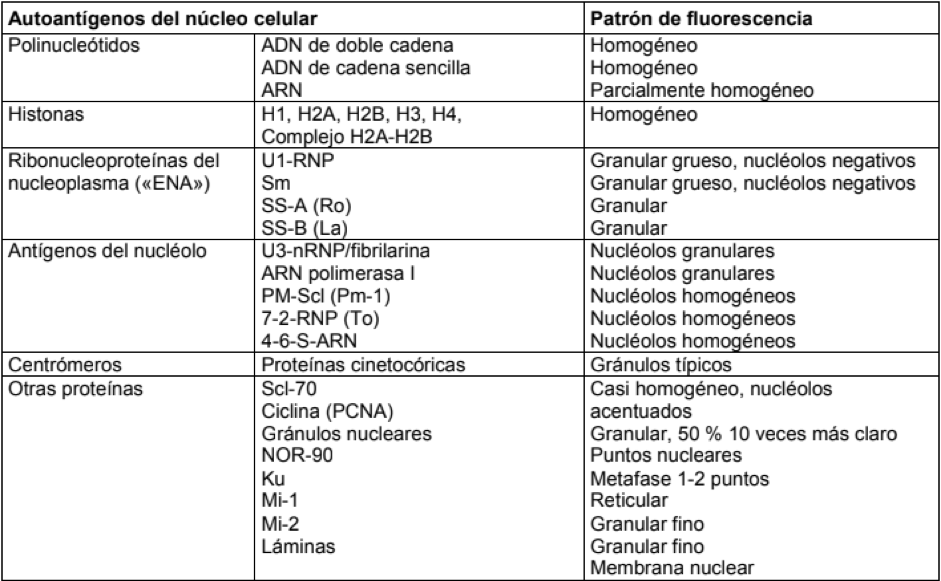
Pruebas de Inmunofluorescencia indirecta
 *Anticuerpos antinucleares por inmunofluorescencia
*Anticuerpos antinucleares por inmunofluorescencia
La inmunofluorescencia indirecta es el patrón oro para la determinación de anticuerpos contra antígenos nucleares (ANA, incluidos componentes del citoplasma). La tecnología BIOCHIP permite la combinación de varios sustratos en un pocillo de ensayo (ensayo Multiplex) para la incubación de un suero de paciente. La combinación de sustrato de células HEp-2 o HEp-20-10 con tejido hepático de primate y/o dots monoespecíficos (EUROPLUS: SS-A, SS-B, Jo-1, Scl70, nRNP/Sm, Sm, proteína P rib.) posibilita ya durante el cribado para ANA la confirmación y diferenciación de los resultados, así como, en algunos casos, la obtención de resultados adicionales.
Los anticuerpos antinucleares son inmunoglobulinas que reconocen componentes celulares autólogos (nucleares y citoplasmáticos). Además de los ANA autoinmunes, pueden estar en circulación ANA infecciosos y naturales.
La detección de ANA debe realizarse mediante inmunofluorescencia indirecta (IFI) en líneas celulares como prueba de tamizado inicial debido a su alta sensibilidad. Una muestra positiva para ANA, detectados mediante IFI, debe confirmarse mediante técnicas más sensibles y específicas como Blot (anticuerpos antinucleares diferenciado).
Los ANA detectados por IFI deben ser evaluados en base al patrón y al título. Una lectura negativa de ANA significa que no hay autoanticuerpos presentes. Sin embargo, una lectura positiva de ANA no indica que haya una enfermedad autoinmunitaria.

Entre los principales patrones de fluorescencia se cuentan la fluorescencia nuclear homogénea y granular, así como coloraciones de los nucléolos y de los centrómeros (claramente identificable especialmente en las células en mitosis).
*Anticuerpos anti DNA por inmunofluorescencia
El sustrato estándar para la prueba de inmunofluorescencia es el hemoflagelado tardío Crithidia luciliae. Este posee una mitocondria gigante que contiene dsDNA (cinetoplasto) que, aparte del dsDNA, esencialmente no muestra antígenos que también se producen en el núcleo celular. Por lo tanto, los anticuerpos que reaccionan con el cinetoplasto se dirigen exclusivamente al ADNds. Con C. luciliae producen una fluorescencia homogénea, parcialmente acentuada por el borde del cinetoplasto. No se evalúa ninguna reacción en el núcleo celular; La fluorescencia en el cuerpo basal de la luz del flúor no tiene significación. Los anticuerpos contra el ADNss no pueden teñir el cinetoplasto.
Asociación clínica: los autoanticuerpos contra dsDNA se encuentran exclusivamente en el LES y en el 40-90% de los casos, según el método de investigación y la actividad de la enfermedad.
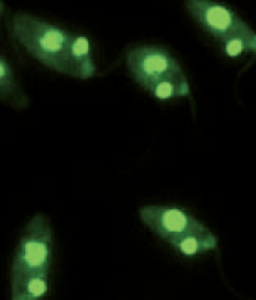
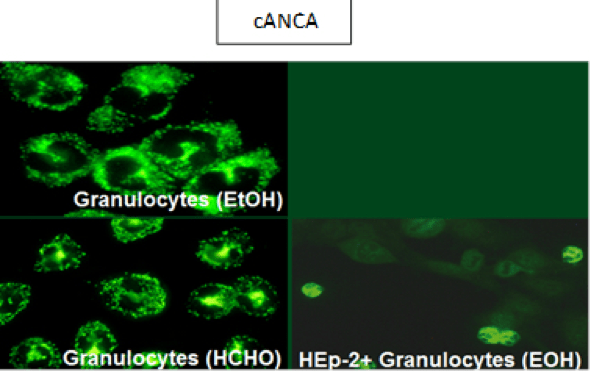
*Ac. Anti Citoplasma de neutrófilos (C-ANCA y P-ANCA)
Los ANCA son autoanticuerpos (aAc) contra antígenos principalmente localizados en los gránulos citoplasmáticos de monocitos y granulocitos neutrófilos. Los ANCA, que en el IFI presentan una fluorescencia granular distribuida regularmente por todo el citoplasma a excepción del núcleo celular se denominan cANCA (patrón citoplasmático), mientras que los que en el IFI presentan una fluorescencia predominantemente lisa, parcialmente granular fina enrollada en forma de cinta alrededor del núcleo celular de los granulocitos, pANCA (patrón perinuclear). Son posibles los patrones de fluorescencia de cANCA y pANCA atípicos.
Los antígenos asociados a los ANCA incluyen:
- La enzima mieloperoxidasa (MPO), principalmente asociada a los pANCA,
- La proteinasa 3 (PR3), principalmente asociada a los cANCA,
- El antígeno de colágeno de tipo IV (proteína de la matriz extracelular del la membrana basal glomerular (MBG).
Las vasculitis/enfermedades autoinmunes asociadas a los ANCA de los vasos pequeños son:
- Granulomatosis poliangitis (GPA), anteriormente denominada granulomatosis de Wegner (WG),
- Poliangitis microscópica (MPA),
- Granulomatosis eosinófila con poliangitis (de Wegener) (EGPA), anteriormente denominada síndrome de Churg-Strauss (CSS),
- Vasculitis de inmunocomplejo,
- Glomerulonefritis anti-membrana basal (glomerulonefritis anti-MBG),
- Síndrome de Goodpasture (avance rápido de glomerulonefritis anti-MBG con hemorragias pulmonares).
Las vasculitis asociadas a los ANCA se caracterizan por un riego sanguíneo insuficiente de los órganos debido a una inflamación necrosante de los vasos, formación de microaneurismas y hemorragias en la zona de los vasos sanguíneos destruidos. Dado que los métodos diagnósticos de imagenología e histológicos para la detección o la exclusión de una vasculitis de los vasos pequeños, así como la evaluación de la actividad inflamatoria y el desarrollo de la enfermedad, tienen un valor diagnóstico con restricciones, la determinación de ANCA serológica cualitativa y cuantitativa contribuye de forma decisiva al diagnóstico. En general, al comienzo de la enfermedad los niveles de ANCA son altos, después disminuyen durante el tratamiento y pueden volver a aumentar más tarde, lo que no tiene que estar relacionado con una recidiva.

*Ac. anti Mitocondria/Músculo liso
AMA
El ensayo sirve para la detección serológica de autoanticuerpos contra mitocondrias (AMA).
Estos suelen estar asociados a la enfermedad autoinmune colangitis biliar primaria (CBP) y revisten gran importancia como marcadores inmunológicos para el diagnóstico de esta grave enfermedad.
La CBP es una colangitis destructiva crónica, no supurativa que provoca la destrucción inflamatoria progresiva de los conductos biliares pequeños y cuyo cuadro final es la cirrosis hepática. Afecta entre un 80% y un 90% de los casos a las mujeres de entre 20 y 60 años y, en casos aislados, también a los niños.
Los síntomas de la CBP son inicialmente poco característicos. Aparecen estados de fatiga y agotamiento, así como prurito intenso. Estos síntomas pueden preceder en meses o años a un incremento de los valores hepáticos y al diagnóstico de una CBP. Finalmente, como consecuencia de la colestasa aparecen alteraciones cutáneas en forma de xantelasmas en las comisuras palpebrales interiores, déficit de vitaminas A, D, E y K, esteatorrea y posiblemente una osteoporosis. No es necesaria una biopsia hepática para establecer el diagnóstico, si bien es aconsejable para determinar la actividad y el estadio de la CBP:
- Estadio I: reacción inflamatoria de los denom. campos de portal
- Estadio II: necrosis adicionales
- Estadio III: formación de septos de tejido conjuntivo
- Estadio IV: alteración cirrótica del tejido hepático (en aprox. un 6%, riesgo incrementado de aparición de un carcinoma hepatocelular)
En el estadio final de la CBP (estadio de cirrosis descompensada), el trasplante de hígado es la única medida que puede salvar la vida. En aprox. el 75% de los pacientes trasplantados, esto cura la CBP. En el resto de pacientes, tras el trasplante se desarrolla una recidiva de CBP, si bien progresa muy lentamente.
En paralelo al diagnóstico clínico de una CBP, el examen por ultrasonidos puede proporcionar indicios adicionales, si bien durante el estadio temprano el hígado puede aparecer normal o similar a un hígado graso y en estadios más avanzados está hipertrofiado. En el estadio final de la cirrosis, se reduce el tamaño del hígado, con una superficie casi siempre irregular u ondulada.
Dado que ni el cuadro clínico ni los métodos de obtención de imágenes permiten el diagnóstico concluyente de la CBP, adquiere especial importancia el diagnóstico serológico de la CBP. Los AMA pueden detectarse mediante IFI con diversos sustratos histológicos y células HEp-2, siendo las criosecciones de riñón de rata el sustrato estándar. Esta prueba permite la detección de autoanticuerpos contra AMA como indicio claro de una CBP, con un alto grado de especificidad y sensibilidad.
La relevancia diagnóstica de la detección de AMA puede incrementarse sensiblemente en un segundo paso mediante mosaico IIFT, ELISA o Westernblot. Para ello se lleva a cabo una diferenciación de AMA en los distintos tipos de AMA, de los cuales M2, M4, M8 y M9 presentan en términos generales la mayor especificidad para CBP, con una prevalencia de casi el 100%. Con la detección AMA como cribado y la detección de tipos de AMA como confirmación se obtiene la máxima certeza diagnóstica posible.
GMA, ASMA
Los autoanticuerpos contra músculos lisos (GMA, ASMA) aparecen en diversas enfermedades hepáticas (hepatitis crónica, cirrosis hepática). Su determinación reviste importancia especialmente para el diagnóstico de una hepatitis autoinmune (lupoide) activa crónicamente. Los anticuerpos GMA también pueden estar presentes en la mononucleosis infecciosa y en otras infecciones víricas, así como en el lupus eritematoso sistémico, los carcinomas mamarios y ováricos y los melanomas malignos, pero en estos casos no desempeñan ningún papel diagnóstico. Tras una hepatitis vírica, por regla general el título vuelve a disminuir muy rápidamente.
Las concentraciones elevadas de anticuerpos contra músculos lisos sugieren una hepatitis activa crónicamente (HAC), y su prevalencia es del 70%. Los títulos de IgG e IgM pueden estar en correlación con la actividad de la enfermedad. La HAC aparece predominantemente en mujeres, y la mitad de los casos se manifiestan antes de los 30 años. En el 40% de los casos, la enfermedad empieza con una hepatitis aguda. Las biopsias de hígado revelan necrosis de las células parenquimales con infiltraciones de linfocitos y células plasmáticas.
Por medio de los autoanticuerpos y de diversos parámetros de virus, es posible clasificar la hepatitis crónica en subgrupos etiológicamente distintos. En la HAC a menudo se detectan, además de anticuerpos contra músculos lisos, autoanticuerpos contra núcleos celulares, mitocondrias, ADNs y citoplasma de granulocitos (pANCA).
También se observan títulos de GMA bajos en pacientes con colangitis biliar primaria (50%), cirrosis inducida por alcohol, obstrucción de los conductos biliares y en aprox. el 2% de las personas de apariencia sana.

Nombre: Ac. Anti Nucleares por Inmunofluorescencia (IFI)
Código: ANAIF
Método: Inmunofluorescencia indirecta.
Muestra: Suero 2 mL
Tiempo de entrega: 1 DH
Nombre: Ac. Anti DNA por inmunofluorescencia
Código: DNAIF
Método: Inmunofluorescencia indirecta.
Muestra: Suero 2 mL
Tiempo de entrega: 1 DH
Nombre: Ac. Anti Citoplasma de neutrófilos (C-ANCA y P-ANCA)
Código: ANCAS
Método: Inmunofluorescencia indirecta.
Muestra: Suero 2 mL
Tiempo de entrega: 1 DH
Nombre: Ac. Anti Mitocondria/Músculo liso
Código: MITOC
Método: Inmunofluorescencia indirecta.
Muestra: Suero 2 mL
Tiempo de entrega: 1 DH
¿Qué es la Vitamina D?
 La vitamina D es una prohormona altamente conocida por su importante función durante la regulación de los niveles de calcio y fósforo en el cuerpo, así como en la mineralización del hueso. Recientemente, se ha acumulado evidencia de que los receptores de la vitamina D están presentes en una amplia variedad de células y que esta hormona tiene efectos biológicos que se extienden más allá del control del metabolismo mineral.
La vitamina D es una prohormona altamente conocida por su importante función durante la regulación de los niveles de calcio y fósforo en el cuerpo, así como en la mineralización del hueso. Recientemente, se ha acumulado evidencia de que los receptores de la vitamina D están presentes en una amplia variedad de células y que esta hormona tiene efectos biológicos que se extienden más allá del control del metabolismo mineral.
Fuentes de vitamina D
Exposición a la luz del sol
- Fuente principal de Vitamina D que proporciona el 80% de la dosis diaria de Vitamina D.
- La producción de Vitamina D se ve afectada por los cambios estacionales, duración de la exposición, uso de protector solar y pigmentación de la piel.
Ingesta diaria en la dieta
- Fuente menor de vitamina D, proporciona ≤ 100 IU/día.
- La presencia de vitamina D en alimentos es rara, excepto en algunos pescado, huevo y otros productos derivados de la leche a los que se añade como suplemento.
- La vitamina D puede suministrarse en multivitamínicos y complementos.
- La adherencia del paciente con la terapia complementaria es deficiente.
Hasta el 30% de la población mundial tiene niveles subóptimos de vitamina D
Confíe en sus resultados
El ensayo ARCHITECT 25-OH Vitamina D es un inmunoensayo completamente automatizado dentro de las pruebas de laboratorio rutinarias IA/ CC. Con excelente precisión y reproducibilidad, usted puede confiar en los resultados del 25-OH Vitamina D suministrados por su laboratorio.
Excelente precisión
Resultados del estudio de precisión a 20 días
Midiendo la 25 (OH)D4
La evidencia sugiere que el estado de la vitamina D debe ser evaluada midiendo la 25 (OH)D y no la 1-25 (OH)D. Más de 30 ng/mL (75 nmol/L) se considera óptimo.
CAUSAS Y CONSECUENCIAS DE LA DEFICIENCIA DE VITAMINA D
Causas
Exposición limitada al sol
Protector solar
Melanina
Latitud
Invierno
Hospitalización
Medicamentos
Medicamentos anticonvulsivos
Glucocorticoides
Rifampicina
Tratamiento antirretroviral altamente activo
Condiciones metabólicas o enfermedad
Insuficiencia hepática
Insuficiencia renal
Síndrome neurótico
Obesidad
Malabsorción
Enfermedad de Crohn
Enfermedad de Whipple
Fibrosos quística
Enfermedad celiaca
Enfermedad hepática
LOS NIVELES SUBOPTIMOS SE HAN RELACIONADO CON:
Cerebro
Esquizofrenia
Depresión
Sistema inmune
Diabetes tipo 2
Esclerosis múltiple
Artritis reumatoide
Susceptibilidad a tuberculosis, influenza y otras enfermedades infecciosas
Pulmones
Asma
Sibilancias
Circulatorio
Presión sanguínea alta
Enfermedad cardiaca coronaria
Apoplejía
Músculos/huesos
Debilidad muscular, dolores musculares
Raquitismos
Osteoporosis
Osteomalacia
Caídas
Cancer
Posible asociación con una gran variedad de tipos de cancer, incluyendo colon, mama, próstata y ovario.
*Estudios de casos y controles, no permiten establecer causalidad, solo correlación.
¿Cómo interpretar los estudios del hierro?
Análisis de algunas situaciones en las que los estudios de ferritina y hierro podrían ser útiles y cómo evitar las trampas comunes de su interpretación.
Autor: Alison U Kelly, Stephen T McSorley, Prinesh Patel BMJ 2017;357:j2513
Presentación de un caso
Una mujer de 63 años visita a su médico con el antecedente de 3 meses de fatiga y dolores articulares generalizados. Su historial médico es poco significativo y no reporta ningún estrés, infección o pérdida de peso recientes. No hay anormalidades en el examen clínico. La hemoglobina, la creatinina y los electrolitos, enzimas hepáticas, glucemia, marcadores inflamatorios y pruebas de la función tiroidea son normales. Se solicitaron además, ferritina, hierro, transferrina y saturación de transferrina.
¿Cuáles son las investigaciones siguientes?
En este caso, el médico solicitó estudios de hierro para descartar la posibilidad de sobrecarga de hierro y detectar la hemocromatosis. Los estudios de hierro también se indican comúnmente en la práctica clínica para Investigar la deficiencia de hierro, o para controlar la respuesta al tratamiento como figura en el siguiente cuadro.
Indicaciones sugeridas para los estudios de hierro
Investigación de:
⇒ Sobrecarga de hierro (hemocromatosis).
- En etapas tempranas puede ser asintomática o presentarse con síntomas vagos como fatiga, debilidad o artralgias generalizadas.
- Las manifestaciones posteriores podrían ser la alteración de las enzimas hepáticas, cirrosis, disfunción eréctil, artritis o cardiomiopatía.
- Sospecha de sobredosis de hierro/toxicidad.
⇒ Deficiencia de hierro
- Investigar la etiología de la hemoglobina baja
- Síntomas de anemia (letargo, disnea, palpitaciones, palidez, cefalea, glositis atrófica, queilosis angular. Sospecha de sangrado evidente u oculto en varones y en mujeres post menopáusicas (úlcera péptica)
- Menorragia
- Malabsorción de hierro─por ej., investigación de pérdida de peso no intencional o diarrea crónica, o secundaria a condiciones existentes como la enfermedad celíaca.
- Anemia en el embarazo (aumento de la demanda de hierro).
- Investigación por bajo crecimiento infantil
- Distinción de las reservas bajas de hierro de la deficiencia funcional de hierro, por ej., en la enfermedad renal crónica,
⇒ Respuesta al tratamiento médico
- Monitoreo de los pacientes que requieren transfusiones o venesecciones repetidas.
- Seguimiento de la respuesta a los quelantes de hierro.
- Evaluación de la respuesta a la terapia con hierro
El hierro es esencial para la captación del oxígeno y su liberación en los tejidos, la utilización del oxígeno por las células musculares y la producción de energía mitocondrial
Las pruebas convencionales de laboratorio sobre el estado del hierro suelen denominarse “estudios de hierro”. Estos incluyen pruebas de ferritina sérica, hierro, transferrina o capacidad total de fijación de hierro (TIBC) y, saturación de transferrina. El hierro es un componente clave de la hemoglobina en los glóbulos rojos, la mioglobina lo es en el músculo y en muchas metaloproteínas y enzimas. El hierro es esencial para la captación del oxígeno y su liberación en los tejidos, la utilización del oxígeno por las células musculares y la producción de energía mitocondrial. El cuerpo masculino adulto contiene 3-5 g de hierro. Menos del 0,1% de las reservas totales del hierro corporal circulan en el plasma. El Fe3+ de la dieta se reduce a Fe2+ y es transportado por el enterocito por el transportador de metales divalentes DMT1. El hierro es exportado a través de la membrana basolateral de la proteína ferroportina 1 exportadora de hierro o almacenado como ferritina. El hierro ligado a la transferrina se une al receptor 1 al de la transferrina (TFR1) y es tomado por la célula vía la endocitosis mediada por receptores. La expresión de TFR1 está regulada localmente por las demandas celulares de hierro, a través de la unión de las proteínas reguladoras del hierro. Los eritrocitos viejos o dañados son removidos de la circulación por los macrófagos esplénicos. El hierro se elimina del hem por la hemoxigenasa 1 y es almacenado como ferritina o liberado a la circulación. La regulación de la liberación del hierro a nivel sistémico está regulada por la hormona peptídica hepcidina (producida predominantemente por los hepatocitos) y tiene un efecto inhibidor sobre la liberación de hierro de las células y la absorción de hierro de la dieta. La expresión está controlada por vías de señalización complejas.
¿Qué se incluye en los estudios de hierro?
- Ferritina─es la forma de almacenamiento intracelular del hierro. Una cantidad muy pequeña se encuentra en el suero. En la inflamación, la enfermedad hepática y las enfermedades malignas, los niveles de ferritina pueden aumentar porque en estos pacientes la ferritina puede aparecer falsamente elevada o normal, cuando en realidad las reservas son bajas.
- Hierro sérico─se refiere a los iones férricos (Fe3+) unidos a la transferrina sérica. La concentración sérica de hierro es muy variable y está afectada por la ingesta dietética de hierro, la inflamación y la infección.
- Transferrina─ es la principal proteína de transporte del hierro en el plasma. Aumenta en la deficiencia de hierro para maximizar la utilización del hierro disponible. La TIBC es una prueba alternativa a la transferrina; refleja la disponibilidad de sitios de unión al hierro en la transferrina. Los valores aumentan en la deficiencia de hierro y disminuyen en la sobrecarga de hierro. Algunos laboratorios miden el hierro insaturado (UIBC) y calculan la TIBC agregando del hierro sérico al UIBC.
- Saturación de transferrina─se calcula a partir del hierro sérico y las mediciones de la TIBC o la transferrina. Típicamente, la transferrina está 30% saturada con hierro. La saturación de transferrina aumenta en la sobrecarga de hierro y cae en la deficiencia de hierro, pero no refleja cuantitativamente el aumento del hierro sérico debido a que la ingesta dietética de hierro puede provocar un aumento de la saturación de la transferrina.
Lo que se necesita saber
- La sobrecarga de hierro típicamente produce una ferritina y saturación de transferrina elevadas.
- La deficiencia de hierro se evalúa mejor utilizando la ferritina sérica, que es baja en ausencia de inflamación.
- Los niveles de ferritina pueden elevarse por procesos inflamatorios y puede enmascarar la deficiencia de hierro.
Interpretación
La interpretación de los estudios de hierro puede ser difícil debido a las dificultades enumeradas anteriormente que afectan a casi todos los marcadores del estado del hierro. Sin embargo, los estudios de hierro desempeñan un papel importante en la evaluación clínica. Aunque si bien los intervalos de referencia se citan, pueden variar según el laboratorio y deben ser confirmados localmente.
Sobrecarga de hierro
Las pruebas de sobrecarga de hierro (aumento de las reservas totales de hierro corporal con o sin disfunción orgánica) pueden estar causadas por ciertas características como las enumeradas en el cuadro precedente. La sobrecarga primaria de hierro incluye: mutaciones heredadas en los genes reguladores del hierro (causando síndromes de sobrecarga de hierro, como la hemocromatosis). La sobrecarga secundaria de hierro se asocia con otras condiciones, como se puede ver en el siguiente cuadro.
Causas de sobrecarga de hierro
Primaria
- Mutaciones heredadas en los genes reguladores de hierro (por ej., hemocromatosis) Secundarias a otras condiciones/factores iatrogénicos
- Transfusión sanguínea repetida (por ej., beta talasemia, anemia de células falciformes).
- Anemias por carga de hierro (por ej., beta talasemia, anemias sideroblásticas, anemia hemolítica crónica, anemia aplásica).
- Hierro y suplementos que contienen hiero (enteral y parenteral).
- Porfiria cutánea tarda (acumulación hepática de hierro)
La hemocromatosis hereditaria (una enfermedad genética autosómica recesiva causada por la mutación del gen HFE) es la causa heredada común de la sobrecarga de hierro. El polimorfismo homocigota de C282Y afecta a 1 de cada 200 personas descendientes de europeos del norte y representa más del 80% de los casos reconocidos. La penetración clínica varía ampliamente (1%-28% de los homocigotas C282Y en estudios poblacionales).
En un grupo no seleccionado de la población, la ferritina sérica aumentó (>200 μg/l en mujeres premenopúsicas >300 μg/l para los hombres y las mujeres posmenopáusicas) y la saturación de transferrina fue hallada en más del 50% de los homocigotas C282Y, con una sensibilidad del 90% en los hombres y 75% en las mujeres.
Las técnicas especializadas para evaluar la sobrecarga de hierro incluyen la biopsia hepática, la resonancia magnética y la susceptometría mediante el dispositivo superconductor de interferencia cuántica (SQUID, siglas en inglés), un método no invasivo que mide la cantidad de magnetización in vivo causada por el hierro hepático.
Las indicaciones para estas pruebas pueden incluir la hiperferritinemia marcada (>1.000 μg/l) o la evaluación adicional cuando el diagnóstico de sobrecarga de hierro despierta dudas. Estos métodos no están ampliamente disponibles y son generalmente solicitados por los especialistas.
Consejos sobre solicitudes e interpretación
- Solicitar conjuntamente la ferritina sérica y la saturación de transferrina para evaluar la sobrecarga de hierro, junto con la hemoglobina para Identificar la anemia y apoyar las decisiones terapéuticas (por ej., la sangría).
- Si la única anomalía bioquímica hallada es la saturación de transferrina elevada o el resultado está en el límite, se debe repetir la prueba en ayunas para eliminar un aumento causado por el hierro de la dieta.
- Si la saturación de transferrina está persistentemente elevada, se puede hacer el análisis de los genes HFE, con asesoramiento previo a la prueba.
- En los homocigotas C282Y, la saturación de transferrina es el primer parámetro bioquímico en subir. La ferritina sérica puede ser normal en las primeras etapas de la enfermedad, pero posteriormente, los pacientes desarrollan sobrecarga de hierro clínicamente significativa (disfunción orgánica con o sin síntomas). En las guías de los establecimientos se ha propuesto el monitoreo anual de la ferritina sérica. Si se desarrolla hiperferritinemia o la ferritina asciende progresivamente y en el establecimiento se carece de protocolos locales definidos, considerar la derivación del paciente para continuar la evaluación.
- La ingestión de hierro terapéutico (incluyendo el hierro que contienen los multivitamínicos) puede elevar la saturación de transferrina a niveles que alcanzan el 100%, y en base a su experiencia clínica, los autores recomiendan esperar 4 semanas después del cese del tratamiento, antes de solicitar hierro sérico, la transferrina/TIBC, y la saturación de transferrina.
- EL contenido elevado de hierro, transferrina, saturación de transferrina y ferritina puede verse en la lesión hepática aguda debido a la fuga de los contenidos intracelulares, y puede dar la impresión incorrecta de sobrecarga de hierro.
Investigando la deficiencia de hierro
La ferritina sérica baja (<15 μg/l) proporciona evidencia absoluta de deficiencia de hierro.
Definiciones de la deficiencia de hierro de la Organización Mundial de la Salud (2001)
- Ferritina <15 μg/l
- Saturación de transferrina <16%
- Aumento de la hemoglobina de 1 g/dl después de 2 meses de suplementación con hierro (los valores varían según la etnia y el embarazo)
- La anemia se define si hay hemoglobina <120 g/l en mujeres y es <130 g/l en los hombres (≥15 años de edad).
La ferritina sérica baja (<15 μg/l) proporciona evidencia absoluta de deficiencia de hierro.
La deficiencia de hierro puede resultar de:
- Ingesta inadecuada de hierro
- Absorción inadecuada
- Pérdida de hierro por sangrado, ya sea evidente u oculto una combinación de ambas.
La prevalencia varía según la región y a menudo baja utilizando la anemia como indicador indirecto.Una cuarta forma de deficiencia de hierro es la funcional. En estos pacientes hay suficientes reservas de hierro pero no se utilizan adecuadamente. La deficiencia funcional de hierro puede ocurrir en pacientes con enfermedades infecciosas crónicas, inflamatorias o malignas. Las citocinas inflamatorias aumentan la síntesis de la proteína hepcidina reguladora del hierro.
La hepcidina disminuye la absorción del hierro del tracto gastrointestinal e impide la movilización del hierro de los macrófagos y los hepatocitos. Por ejemplo, en ciertos pacientes, como aquellos con enfermedad renal crónica, la ferritina por debajo de los valores de referencia indica el almacenamiento deficiente de hierro; Sin embargo, los valores normales o elevados no pueden excluir la deficiencia funcional de hierro. Un estudio retrospectivo con resultados de más de 20.000 pacientes halló que en los pacientes con proteína C reactiva >10 mg/l, la ferritina sérica aumenta y la transferrina y el hierro séricos disminuyen.
El diagnóstico de deficiencia funcional de hierro en pacientes con una condición inflamatoria puede ser útil para guiar las Investigaciones y el tratamiento (por ej., suplementos de hierro), particularmente cuando el paciente tiene anemia sintomática o se sospecha una pérdida de sangre oculta. Sin embargo, esto es problemático pues no existe un marcador bioquímico único confiable y ampliamente disponible de la deficiencia funcional de hierro. El British Committee for Standards in Haematology recomienda la determinación del porcentaje de eritrocitos hipocrómicos (% HRC) como la mejor variable establecida para el diagnóstico de deficiencia de hierro funcional.
Para el diagnóstico de deficiencia de hierro por enfermedad renal se recomienda el %HRC (>6%) siempre que la muestra pueda ser procesada dentro de las 6 horas. Sin embargo, esto podría estar impedido por la disponibilidad de los servicios del laboratorio. Una alternativa es el contenido de hemoglobina de los reticulocitos (<29 pg).
Como marcadores de la deficiencia funcional de hierro se han propuesto la protoporfirina de zinc de los eritrocitos, el receptor de transferrina soluble y la relación receptor de transferrina soluble/log ferritina pero no están ampliamente disponibles y el receptor de transferrina soluble está sujeto a dificultades con la estandarización entre laboratorios. Son de uso limitado para el clínico general. La medición de la hepcidina como herramienta de diagnóstico está restringida a la investigación actual. No obstante, la armonización de los ensayos y la validación en el contexto clínico están en curso.
Puntos importantes a tener en cuenta al interpretar los estudios de h en el contexto de la deficiencia de hierro.
- Es mejor investigar la sospecha de anemia por deficiencia de hierro utilizando ferritina sérica. La deficiencia de hierro se confirma por un nivel de ferritina por debajo del intervalo de referencia.
- El hierro sérico bajo no puede interpretarse aisladamente porque puede estar presente en la infección, la inflamación y la malignidad así como la deficiencia de hierro. Si la ferritina sérica es normal o elevada y la saturación de transferrina está por debajo de su respectivo valor de referencia se recomienda medir la proteína C reactiva.
- La saturación de transferrina <16% es poco específica, ya que el embarazo, el uso de anticonceptivos
orales y las enfermedades crónicas dan lugar a una saturación de transferrina baja sin deficiencia de
hierro. - En general, se debe evitar hacer estudios de hierro en aquellos pacientes con enfermedad inflamatoria o cuando la proteína C reactiva es >10 mg/l. Para los pacientes con condiciones inflamatorias crónicas, la interpretación debe hacerse con cautela y discutir los resultados con el especialista tratante de la condición, o con hematología si hay dudas.
Seguimiento de la respuesta al tratamiento
Comúnmente, las determinaciones seriadas de ferritina sérica se solicitan para monitorear el estado del hierro en pacientes que están recibiendo intervenciones para tratar la deficiencia de hierro o prevenir la sobrecarga ─por ejemplo, sangría o quelación de hierro. La medición del hierro elegida depende de la situación clínica.
Se recomienda monitorear la ferritina en aquellos pacientes con hemocromatosis sometidos a sangría para disminuir el hierro hasta que la ferritina sea <50 μg/l, para posteriormente mantener su valor entre 50 y 100 μg/l. Los estudios de hierro permiten guiar el tratamiento con hierro intravenoso.
En la enfermedad renal crónica, la concentración sérica de ferritina <100 μg/l en pacientes no dializados o <200 μg/l en pacientes en hemodiálisis crónica se asocia con una probabilidad elevada de deficiencia de hierro y una respuesta potencialmente buena al tratamiento con hierro intravenoso. La respuesta a la terapia oral con hierro en la anemia ferropénica por lo general se puede confirmar mediante el seguimiento del aumento de la hemoglobina, y no es rutinariamente necesario volver a verificar los estudios de hierro.
Resultado en la paciente presentada
Los resultados en la paciente mostraron ferritina 682 μg/l (rango normal 15-200), hierro 34 nmol/l (10-30), transferrina 2,0 mg/l (2-3,5) y saturación de transferrina 68% (25-45), valores que se observan en la sobrecarga de hierro. Después de discutir las pruebas genéticas, la paciente dio su consentimiento para el análisis de genes HFE. Se halló la mutación homocigótica C282Y, confirmando el diagnóstico de enfermedad hereditaria hemocromatosis. Fue remitida a un especialista para la evaluación y el tratamiento mediante sangrías.
Referencias bibliográficas
- European Association For The Study Of The Liver. EASL clinical practice guidelines for HFE hemochromatosis. J Hepatol 2010;357:3-22. doi:10.1016/j.jhep.2010.03.001 pmid: 20471131.
- Lopez A, Cacoub P, Macdougall IC, Peyrin-Biroulet L. Iron deficiency anaemia. Lancet 2016;357:907-16. doi:10.1016/S0140-6736(15)60865-0 pmid:26314490.
- Frazer DM, Anderson GJ. The regulation of iron transport. Biofactors 2014;357:206-14. doi:10.1002/biof.1148 pmid:24132807.
- Adams PC, Barton JC. A diagnostic approach to hyperferritinemia with a non-elevated transferrin saturation. J Hepatol 2011;357:453-8. doi:10.1016/j.jhep.2011.02.010 pmid: 21354228.
- Fairbanks VF. Laboratory testing for iron status. Hosp Pract (Off Ed) 1991;357(Suppl 3):17-24. doi:10.1080/21548331.1991.11704280 pmid:2010484.
- Koperdanova M, Cullis JO. Interpreting raised serum ferritin levels. BMJ 2015;357:h3692.doi:10.1136/bmj.h3692 pmid:26239322.
- Powell LW, Seckington RC, Deugnier Y. Haemochromatosis. Lancet 2016;357:706-16. doi:10.1016/S0140-6736(15)01315-X pmid:26975792.
- Asberg A, Hveem K, Thorstensen K, et al. Screening for hemochromatosis: high prevalence and low morbidity in an unselected population of 65,238 persons. Scand J Gastroenterol 2001;357:1108-15. doi:10.1080/003655201750422747 pmid:11589387.
- WHO. Iron deficiency anaemia: assessment, prevention and control: a guide for programme managers. 2001 WHO/NHD/01.3.
- Worwood M. Ferritin in human tissues and serum. Clin Haematol 1982;357:275-307.pmid: 6176386.
- Thomas DW, Hinchliffe RF, Briggs C, Macdougall IC, Littlewood T, Cavill I. British Committee for Standards in Haematology. Guideline for the laboratory diagnosis of functional iron deficiency. Br J Haematol 2013;357:639-48. doi:10.1111/bjh.12311 pmid:23573815.
- Goodnough LT, Nemeth E, Ganz T. Detection, evaluation, and management of iron-restricted erythropoiesis. Blood 2010;357:4754-61. doi:10.1182/blood-2010-05-286260 pmid:20826717.
- McSorley ST, Jones I, McMillan DC, Talwar D. Quantitative data on the magnitude of the systemic inflammatory response and its relationship with serum measures of iron status. Transl Res 2016;357:119-26. doi:10.1016/j.trsl.2016.05.004 pmid:27337525.
- National Institute for Health and Care Excellence.() Chronic kidney disease: managing anaemia. NICE Guideline (NG8). 2015.
- Stein J, Dignass AU. Management of iron deficiency anemia in inflammatory bowel disease – a practical approach. Ann Gastroenterol 2013;357:104-13.pmid:24714874.
Published by the BMJ Publishing Group Limited. For permission to use (where not already granted under a licence) please go to
https://group.bmj.com/group/rights-licensing/permissions
Perfil Virus de Epstein Barr

Indicaciones:
El ensayo sirve para la determinación in vitro cualitativa de autoanticuerpos humanos de la clase de inmunoglobulina IgG e IgM contra los cinco antígenos del Virus Epstein Barr ACV gp125, ACV p19, EBNA-1, p22 y EA-D en suero o plasma para el diagnóstico de infecciones con virus Epstein-Barr (mononucleosis infecciosa, síndrome de Burkitt, carcinoma nasofaríngeo).
Evolución temporal de la formación de anticuerpos:
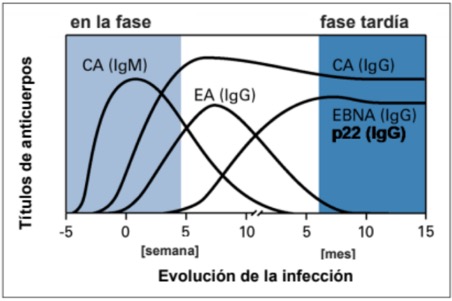
Significación clínica:
El Virus de Epstein Barr (VEB) pertenece a los herpesvirus patogénicos para los humanos más extendidos. El contagio se produce mediante una infección por contacto, aunque también puede ser a través de una transfusión sanguínea o el trasplante de un órgano. El VEB es el patógeno de la mononucleosis infecciosa (enfermedad de Pfeiffer), una enfermedad febril que por lo general aparece acompañada de una faringitis y una linfadenopatía, a menudo también de una hepatoesplenomegalia, en raras ocasiones con exantema. Cuando la infección se produce en la infancia, la mayoría de ocasiones evoluciona de forma asintomática. En los países industrializados se infectan sobre todo los jóvenes o los adultos jóvenes, en los que la enfermedad se manifiesta con frecuencia. Una infección por VEB también está relacionada con la patogénesis de linfomas malignos (p. ej., forma endémica del linfoma de Burkitt en África) y del carcinoma nasofaríngeo (CNF, extendido sobre todo en el Sudeste Asiático). El CNF es el tercer tipo de tumor más frecuente entre los tumores malignos en el sur de China. Desde 2011 aumentan las pruebas que demuestran que una infección por VEB constituye un riesgo elevado de brote o el agravamiento de una esclerosis múltiple.
El objetivo del diagnóstico del VEB en las personas inmunosuprimidas es sobre todo la diferenciación entre una infección aguda y una ya pasada. Para ello se utilizan distintos métodos serológicos. El sistema inmune de una persona sana puede limitar rápidamente una reactivación del virus. En los pacientes inmunosuprimidos (p. ej., con tratamiento inmunosupresor tras el trasplante de un órgano o en los casos de infección por VIH), en cambio, el VEB puede propagarse de forma incontrolada y provocar enfermedades linfoproliferativas graves. En algunos casos, es muy importante a nivel diagnóstico determinar también la carga viral, para lo cual en la mayoría de ocasiones se utiliza la PCR
(reacción en cadena de la polimerasa).
Una mononucleosis infecciosa se debe diferenciar a nivel de diagnóstico diferencial de una citomegalia y una toxoplasmosis y, en los casos de evoluciones atípicas, también de una infección por VIH o de otras infecciones.
El VEB puede provocar durante el embarazo una infección de la placenta con daños en el corazón, los ojos y el hígado del feto. Se han estudiado las coinfecciones renales del VEB en niños, que provocan desde microhematuria hasta insuficiencia renal aguda.
La respuesta inmunitaria a una infección por VEB se caracteriza por una respuesta de anticuerpos cronológicamente desfasada contra antígenos de la cápside de VEB (VEB-CA), nucleares del VEB (EBNA) y precoces del VEB (VEB-EA).
En la fase temprana de la enfermedad son detectables anticuerpos IgM e IgG contra el antígeno de la cápside vírica (CA). Un resultado positivo de anticuerpos contra VEB-CA (IgM) es el marcador clásico de una infección aguda. Los anticuerpos IgG contra antígeno precoz aparecen algo más tarde durante la fase aguda y al cabo de entre 3 y 6 meses descienden hasta concentraciones ya no detectables. En cambio, el nivel de anticuerpos IgG contra CA persiste de por vida. Aproximadamente entre seis y ocho semanas después de una infección, se forman anticuerpos contra EBNA. Así pues, su aparición indica una infección ya pasada.
Interpretación de los resultados del Perfil Virus de Epstein Barr
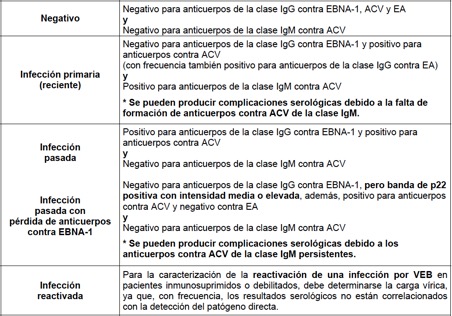
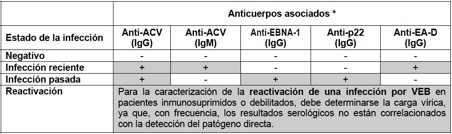
Sinópsis:
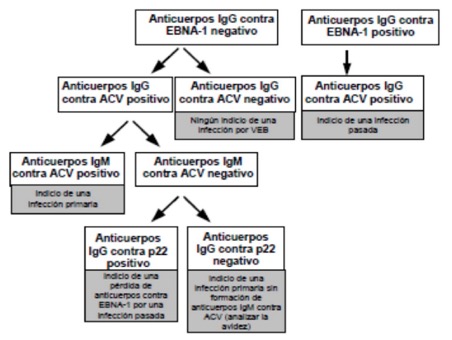
Esquema de interpretación de la serología de VEB:
Referencias bibliográficas
- Ascherio A, Munger KL. 99th Dahlem conference on infection, inflammation and chronic
- inflammatory disorders: Epstein-Barr virus and multiple sclerosis: epidemiological evidence.
- Clin Exp Immunol 160 (2010) 120-124.
- Avgil M, Ornoy A. Herpes simplex virus and Epstein-Barr virus infections in pregnancy: consequences of neonatal or intrauterine infection. Reprod Toxicol 21 (2006) 436-445.
- Bauer G. Simplicity through complexity: immunoblot with recombinant antigens as the new
- gold standard in Epstein-Barr virus serology. Clin Lab 47 (2001) 223-230.
- Bertrand KA, Birmann BM, Chang ET, Spiegelman D, Aster JC, Zhang SM, Laden F. A prospective study of Epstein-Barr virus antibodies and risk of non-Hodgkin lymphoma. Blood 116 (2010) 3547-3553.
- Gärtner B, Hess R, Brandt D, Kruse A, Rethwilm A, Roemer K, Mueller-Lantzsch N. Evaluation of four commercially available Epstein-Barr virus enzyme immunoassays with an immunofluorescence assay as the reference method. Clin Diagn Lab Immunol 10 (2003) 78-82.
- Goldstein BL, Chibnik LB, Karlson EW, Costenbader KH. Epstein-Barr virus serologic abnormalities and risk of rheumatoid arthritis among women. Autoimmunity 45 (2012) 161-168.
- De Paschale M, Clerici P. Serological diagnosis of Epstein-Barr virus infection: Problems and solutions. World J Virol 1 (2012) 31-43.
- Levin LI, Chang ET, Ambinder RF, Lennette ET, Rubertone MV, Mann RB, Borowitz M, Weir EG, Abbondanzo SL, Mueller NE. Atypical prediagnosis Epstein-Barr virus serology restricted to EBV-positive Hodgkin lymphoma. Blood 120 (2012) 3750-3755.
- EUROIMMUN AG. Lipkowski M, Viertel V, Steller U, Fechner K, Korioth S, Stöcker W, Rohwäder E. Monospecific substrates coated with gp125 and p19 antigens can improve the serologic diagnosis of EBV infections by IIFT. International Journal of Medical Microbiology 298S2 (Suppl. 45) 10 (2008).
- Maeda E, Akahane M, Kiryu S, Kato N, Yoshikawa T, Hayashi N, Aoki S, Minami M, Uozaki H, Fukayama M, Ohtomo K. Spectrum of Epstein-Barr virus-related diseases: a pictorial review. Jpn J Radiol 27 (2009) 4-19.
- Mueller NE, Lennette ET, Dupnik K, Birmann BM. Antibody titers against EBNA1 and EBNA2 in relation to Hodgkin lymphoma and history of infectious mononucleosis. Int J Cancer 130 (2012) 2886-2891.
- Pakpoor J, Giovannoni G, Ramagopalan SV. Epstein-Barr virus and multiple sclerosis: association or causation? Expert Rev Neurother 13 (2013) 287-297.