Analitos
Analitos incluidos en el estudio Química Sanguínea Integral
Glucosa: La glucosa es una fuente primaria de energía celular. Las concentraciones de glucosa plasmática en ayunas y la tolerancia a una dosis de glucosa se utilizan para establecer el diagnóstico de la diabetes mellitus y los trastornos del metabolismo de los hidratos de carbono. Las determinaciones de la glucosa se utilizan para supervisar el tratamiento en las personas diabéticas y en pacientes con deshidratación, coma, hipoglucemia, insulinoma, acidosis y cetoacidosis.
Ácido úrico: es el producto final del metabolismo de la purina. Se producen elevaciones del ácido úrico en situaciones como insuficiencia renal, azotemia prerrenal, gota, intoxicación por plomo, destrucción celular excesiva (por ejemplo, después de quimioterapia), anemia hemolítica, insuficiencia cardíaca congestiva y después de un infarto de miocardio. El ácido úrico también aparece aumentado en algunos trastornos endocrinos, acidosis, toxemia del embarazo, gota hereditaria y enfermedad por acumulación de glucógeno tipo I. Después del tratamiento con algunos medicamentos (por ejemplo, aspirina a dosis bajas), con un consumo de purinas en la dieta bajo, en presencia de defectos de los túbulos renales y en la xantinuria, pueden encontrarse concentraciones bajas de ácido úrico.
Proteínas totales: Las proteínas séricas transportan fármacos y metabolitos y mantienen la presión osmótica en el plasma. La mayoría de las proteínas séricas, a excepción de las gammaglobulinas, se sintetizan en el hígado. Una de las proteínas séricas más importantes que produce el hígado es la albúmina. La concentración de proteínas totales en el suero puede utilizarse en la evaluación del estado nutricional.
Entre las causas de una concentración elevada de proteínas totales en suero figuran la deshidratación, la macroglobulinemia de Waldenström, el mieloma múltiple, la hiperglobulinemia, las enfermedades granulomatosas y algunas enfermedades tropicales. La concentración de proteínas totales está ocasionalmente aumentada en las enfermedades del colágeno, el lupus eritematoso y otros casos de infección o inflamación crónica. Las causas de una concentración baja de proteínas totales en suero incluyen el embarazo, la administración excesiva de líquidos intravenosos, la cirrosis u otras enfermedades hepáticas, el alcoholismo crónico, la insuficiencia cardíaca, el síndrome nefrótico, la glomerulonefritis, las neoplasias, las enteropatías con pérdida de proteínas, la mala absorción y la desnutrición aguda.
Albúmina: De todas las proteínas séricas, la albúmina es la que se encuentra en la concentración más elevada. Actúa para mantener la presión oncótica y el transporte de numerosas sustancias. Un aumento de la albúmina sérica podría indicar deshidratación o hiper infusión con albúmina; un descenso está relacionado con hidratación rápida, sobrehidratación, malnutrición grave y mala absorción, necrosis hepática difusa grave, hepatitis activa crónica y neoplasia. La albúmina suele estar reducida en el alcoholismo crónico, el embarazo, en los casos de pérdida de proteínas renales, disfunción tiroidea, úlcera péptica y en los procesos inflamatorios crónicos.
Sodio: es el catión más importante de los fluidos extracelulares. El riñón regula el contenido de sodio del organismo. Los niveles bajos de sodio pueden estar causados por una pérdida excesiva de orina, diarrea, enfermedad de Addison y enfermedad de los túbulos renales. Pueden producirse niveles elevados de sodio en la deshidratación aguda, algunos tipos de lesión cerebral, coma diabético e ingestión excesiva de sales de sodio.
Potasio: es el catión más importante del líquido intracelular. La determinación del potasio sérico se utiliza en la evaluación del desequilibrio electrolítico, las arritmias cardiacas, la debilidad muscular, la encefalopatía hepática y la insuficiencia renal así como en la vigilancia de la cetoacidosis en la diabetes mellitus y el tratamiento de reposición hídrica por vía intravenosa.
Más del 90% de los pacientes hipertensos con aldosteronismo tienen cifras bajas de K+; una baja cifra de K+ también es común en los casos de vómitos, diarrea, alcoholismo y deficiencia de ácido fólico. Los valores elevados de K+ se producen cuando se efectúa una infusión rápida de K+, en la nefropatía terminal, en los casos de hemólisis, traumatismo, enfermedad de Addison, acidosis metabólica, inanición aguda y en las urgencias médicas agudas. Normalmente, el K+ es fácilmente filtrado por el glomérulo, pero tiende a ser conservado si el valor de K+ sérico es bajo. El potasio urinario puede elevarse al aumentar el consumo en la dieta, en el hiperaldosteronismo, la acidosis tubular renal y en el comienzo de la alcalosis.
Cloro: es el principal anión del espacio acuoso extracelular; su importancia fisiológica estriba en el mantenimiento de la correcta distribución del agua, la presión osmótica y el equilibrio anión-catión normal en el compartimiento de líquido extracelular. El cloruro aumenta en las situaciones de deshidratación, acidosis de los túbulos renales (acidosis metabólica por hipercloremia) e infusión excesiva de soluciones salinas isotónicas. El cloruro disminuye en la sobrehidratación, la acidosis respiratoria crónica, la nefritis con pérdida de sal, la alcalosis metabólica y la insuficiencia cardíaca congestiva.
Los niveles de cloruro en la orina ayudan a determinar el tipo de alcalosis metabólica (reactividad y resistencia al cloruro).
Dióxido de carbono: El sistema de ácido carbónico–tampón bicarbonato es uno de los sistemas tampón importantes que mantiene el pH de la sangre. Las determinaciones de CO2 total (es decir, bicarbonato más CO2 disuelto) se usan junto con otra información clínica y de laboratorio (pH y pCO2 arterial) en la evaluación de los trastornos ácido-básicos. Por lo general, el CO2 total está aumentado en la acidosis respiratoria, la alcalosis metabólica y cuando se produce un consumo excesivo de productos alcalinos. El CO2 está disminuido en la alcalosis respiratoria compensada, la acidosis metabólica y en los trastornos renales en los que no pueden excretarse los iones H+.
Fosfatasa alcalina: es una enzima que está presente en varios tejidos del organismo como hígado, hueso, riñón, intestino y placenta de las mujeres embarazadas. No obstante, sus concentraciones más elevadas se observan en las células óseas y hepáticas. La fosfatasa alcalina sérica puede estar elevada cuando el metabolismo óseo está aumentado, por ejemplo en los adolescentes y durante la curación de una fractura; el hiperparatiroidismo primario y secundario; la enfermedad de Paget en el hueso; el carcinoma metastásico óseo; el sarcoma osteogénico; y la enfermedad de Hodgkin si los huesos están invadidos. Las enfermedades hepatobiliares que implican colestasis, inflamación o cirrosis aumentan la actividad de la fosfatasa alcalina; la actividad de la fosfatasa alcalina puede estar aumentada en los casos de infarto y fallo renal y en las complicaciones del embarazo. Ocasionalmente puede verse una actividad de fosfatasa alcalina baja en el hipotiroidismo.
Calcio: es el componente mineral del hueso más importante; el 99% del calcio del organismo se encuentra en los huesos. Los iones de calcio desempeñan un papel importante en la transmisión de los impulsos nerviosos y en el mantenimiento de la contracción normal de los músculos. Una concentración anormal de calcio sérico puede ser indicativa de un funcionamiento inadecuado de las glándulas paratiroideas, enfermedades óseas, carcinoma, síndrome de desnutrición y malabsorción, deficiencia de la vitamina D, sobredosis con antiácidos a base de calcio y enfermedades renales.
Fósforo: en forma de fosfato, se distribuye por todo el organismo. Entre las causas de una concentración elevada de fósforo sérico se incluyen la deshidratación, el hipoparatiroidismo, la hipervitaminosis D, las metástasis óseas, la sarcoidosis, la embolia pulmonar, la insuficiencia renal y la diabetes mellitus con cetosis. Se observan concentraciones bajas de fósforo sérico en el hiperparatiroidismo primario y cuando la concentración de calcio aumenta por otras causas, en los casos de sepsis, deficiencia de vitamina D, trastornos de los túbulos renales, hemodiálisis crónica, vómitos y ocasionalmente con una reducción de la ingesta de fosfato de la dieta.
Magnesio: es predominantemente un catión intracelular esencial en las reacciones enzimáticas. La deficiencia de magnesio puede provocar debilidad, temblores, tetania y convulsiones. La hipomagnesemia se asocia a hipocalcemia, alcoholismo, algunos tipos de desnutrición, mala absorción, hemodiálisis crónica y embarazo. Las concentraciones aumentadas de magnesio sérico se producen en pacientes con insuficiencia renal, deshidratación y la enfermedad de Addison.
Colesterol total: está presente en los tejidos, en el suero y en el plasma bien como colesterol o bien como ésteres de colesterol unidos a proteínas. El colesterol es un componente estructural esencial de las membranas celulares y de la capa externa de las lipoproteínas plasmáticas y es el precursor de todas las hormonas esteroides, incluidas las hormonas sexuales y suprarrenales, los ácidos biliares y la vitamina D. Las determinaciones del colesterol se utilizan para valorar el riesgo de desarrollar oclusión de la arteria coronaria, aterosclerosis, infarto de miocardio y enfermedades cerebrovasculares. La aterosclerosis coronaria se correlaciona con niveles elevados de colesterol. Las concentraciones de colesterol están aumentadas en la hipercolesterolemia primaria; la hiperlipoproteinemia secundaria, incluido el síndrome nefrótico; la cirrosis biliar primaria; el hipotiroidismo; y en algunos casos, la diabetes mellitus. Pueden encontrarse concentraciones bajas de colesterol en la desnutrición, la absorción insuficiente, los procesos malignos avanzados y el hiperparatiroidismo. La concentración de colesterol sérico depende de numerosos factores, entre ellos la edad y el sexo.
Triglicéridos: ésteres de ácidos grasos de glicerol, representan la forma más importante de grasa en el organismo; su función principal es la de almacenar y proporcionar energía a las células. La concentración de triglicéridos en el plasma en cualquier momento dado es un equilibrio entre los flujos de entrada y de eliminación. Las concentraciones de triglicéridos en el plasma varían con la edad y el sexo. Durante la fase de crecimiento y desarrollo pueden producirse aumentos moderados. Los triglicéridos se utilizan en la evaluación de las hiperlipemias, asociándose las concentraciones elevadas con la presencia de hipotiroidismo, síndrome nefrótico, enfermedades por acumulación de glucógeno y diabetes mellitus. Las concentraciones extremadamente elevadas de triglicéridos son comunes en la pancreatitis aguda.
Colesterol HDL: El colesterol ligado a lipoproteínas de alta densidad (HDL) se utiliza para evaluar el riesgo de desarrollar cardiopatías coronarias (CC). Este riesgo aumenta con las concentraciones bajas de colesterol HDL.
Colesterol LDL: Las lipoproteínas de baja densidad (LDL) son una de las seis clases principales de lipoproteínas circulantes. Las LDL transportan el colesterol a los tejidos periféricos para la biosíntesis de membranas celulares, al hígado y otros tejidos para la síntesis de hormonas esteroideas y a los hepatocitos para la síntesis de ácidos biliares. Los niveles de colesterol LDL están directamente relacionados con el riesgo de desarrollar cardiopatía coronaria y la reducción del nivel de colesterol LDL en la sangre es un objetivo fundamental de diversos agentes terapéuticos hipocolesterolemiantes.
Proteína C reactiva de alta sensibilidad: reactiva es un reactante de fase aguda que refleja inflamación sistémica de bajo grado. Los aumentos de los valores de CRP son inespecíficos y no deben interpretarse sin una historia clínica completa. Pueden realizarse mediciones de CRP para la detección precoz de la infección en pediatría y para la valoración del riesgo de cardiopatía coronaria. Este riesgo aumenta cuando los valores de CRP exceden 3 mg/L. El ensayo VITROS hsCRP está clasificado como ensayo de la proteína cardiaca C reactiva (cCRP). Los ensayos de CRP cardiaca (cCRP) se utilizan como ayuda en la identificación y estratificación de individuos con riesgo futuro de enfermedad cardiovascular. Cuando se utiliza junto con la evaluación clínica tradicional de síndromes coronarios agudos, cCRP puede ser de utilidad como marcador independiente del pronóstico de casos recurrentes en pacientes con síndrome coronario estable o agudo. Los Centros para el Control y Prevención de Enfermedades y la Asociación Americana del Corazón han hecho las siguientes recomendaciones relativas al uso de la proteína C reactiva de alta sensibilidad (hsCRP) para la valoración del riesgo de enfermedades cardiovasculares :
- La determinación de la hsCRP debe hacerse dos veces (promediando los resultados) óptimamente con un intervalo de dos semanas, en pacientes metabólicamente estables, y debe compararse con valores anteriores. Los análisis no deben realizarse mientras haya una indicación de infección, inflamación sistémica o traumatismo.
- Deben realizarse pruebas de seguimiento de los pacientes con valores de CRP elevados. Los pacientes con valores de hsCRP sistemáticamente inexplicados superiores a 10 mg/L después de análisis repetidos deben ser evaluados en busca de un origen no cardiovascular de la infección o la inflamación.
- Debido a la variabilidad intraindividual, las determinaciones seriadas de la hsCRP no deben utilizarse para supervisar los efectos del tratamiento.
- No se recomienda el cribado de toda la población adulta para detectar hsCRP.
- La hsCRP no es un sustituto de los factores de riesgo cardiovascular tradicionales.
- La aplicación de directrices de tratamiento de los síndromes coronarios agudos no debe hacerse depender de los niveles de hsCRP.
- La aplicación de medidas de prevención secundarias debe basarse en una valoración global del riesgo y no debe depender de las determinaciones de la hsCRP.
Nitrógeno ureico: La vía más importante para la excreción del nitrógeno es en forma de urea que es sintetizada en el hígado, liberada al torrente sanguíneo y eliminada por los riñones. Los niveles elevados del nitrógeno ureico en sangre se asocian con glomerulonefritis, shock, obstrucción de las vías urinarias, pielonefritis y otras causas de insuficiencia renal crónica. La insuficiencia cardíaca congestiva grave, la hiperalimentación, la cetoacidosis diabética, la deshidratación y las hemorragias del tubo digestivo elevan el nitrógeno ureico. Los niveles bajos de nitrógeno ureico se asocian normalmente con el embarazo, un descenso en la ingestión de proteínas, insuficiencia hepática aguda y con la administración intravenosa de líquidos.
Creatinina: La excreción de creatinina sérica y de creatinina urinaria es una función de la masa corporal magra en personas normales que muestra poca o ninguna respuesta a los cambios en la dieta. La concentración de creatinina sérica es más elevada en los varones que en las mujeres. Como la creatinina urinaria se excreta principalmente por filtración glomerular, apareciendo sólo pequeñas cantidades debidas a la secreción tubular, la excreción de creatinina sérica y de creatinina en orina de 24 horas puede utilizarse para calcular la tasa de filtración glomerular.
La creatinina sérica aparece aumentada en la insuficiencia renal aguda y crónica, la obstrucción de las vías urinarias, los casos de reducción del flujo sanguíneo renal, shock, deshidratación y rabdomiólisis. Entre las causas de una concentración baja de creatinina sérica se incluye el debilitamiento y la disminución de la masa muscular. El ejercicio puede provocar un aumento del aclaramiento de creatinina. Si el flujo de orina es bajo, la tasa de aclaramiento de creatinina no es fiable.
Amilasa: es una enzima digestiva amilolítica producida por el páncreas exocrino y las glándulas salivales. La amilasa está aumentada en la pancreatitis aguda, el absceso pancreático o pseudoquiste, el traumatismo de páncreas, la amiloidosis, el neoplasma pancreático, la obstrucción del conducto biliar común y después de cirugía torácica. Se puede observar aumento de la actividad amilasa en la parotiditis y en la insuficiencia renal.
Lipasa: es una enzima digestiva producida principalmente por las células acinares del páncreas exocrino. Su función fisiológica es hidrolizar los triglicéridos de cadena larga en el intestino delgado. La lipasa sérica aumenta rápidamente en pacientes con pancreatitis aguda y recurrente, abscesos pancreáticos o pseudoquistes, traumatismo pancreático, cáncer de páncreas, obstrucción de los conductos biliares comunes e ingestión de fármacos tóxicos para el páncreas. También aumenta en la mayoría de las afecciones inflamatorias que se producen en la cavidad abdominal, enfermedad de las vías biliares, abscesos abdominales e insuficiencia renal. La lipasa es más específica que la amilasa total para establecer un diagnóstico de pancreatitis aguda.
Bilirrubina total: La bilirrubina total en suero y plasma es la suma de la bilirrubina no conjugada (Bu), la bilirrubina conjugada monoglucurónida y diglucurónida (Bc) y la bilirrubina delta (DELB), una fracción de la bilirrubina unida covalentemente a la albúmina.
Excepto en los casos de ictericia anictérica, la bilirrubina sérica total aparece invariablemente aumentada en los casos de ictericia. Las causas de la ictericia son pre-hepáticas, como resultado de diversas enfermedades hemolíticas; hepáticas, las que están causadas por lesiones hepatocelulares u obstrucción; y post-hepáticas, a consecuencia de una obstrucción de los conductos hepáticos o los conductos biliares comunes.
Bilirrubina no conjugada y conjugada: La ictericia se clasifica como hiperbilirrubinemia no conjugada y conjugada. Habitualmente se observan cifras aumentadas de bilirrubina no conjugada plasmática en los trastornos hemolíticos, el síndrome de Gilbert, el síndrome de Crigler-Najjar, la ictericia neonatal, la eritropoyesis incompleta y en presencia de fármacos que compiten por el glucurónido. Las cifras aumentadas de bilirrubina conjugada plasmática se encuentran en trastornos hepatobiliares como la obstrucción del árbol biliar intrahepático y extrahepático, la lesión de células hepáticas, el síndrome de Dubin-Johnson y el síndrome de Rotor. La bilirrubina neonatal, es decir la suma de Bu y Bc, está aumentada en la eritroblastosis fetal (enfermedad hemolítica del recién nacido), que produce ictericia en los dos primeros días de vida. Otras causas de ictericia neonatal son la ictericia fisiológica, el hematoma/hemorragia, el hipotiroidismo y la ictericia obstructiva.
Alanina aminotransferasa: una enzima involucrada en el metabolismo de aminoácidos, se encuentra en muchos tejidos, como en el hígado, el músculo cardíaco y esquelético, los riñones y el páncreas. Por tanto, las elevaciones de ALT se asocian con trastornos tanto hepáticos como no hepáticos, por ejemplo, la hepatitis, la cirrosis, los tumores hepáticos, la obstrucción biliar, el síndrome de Reye, la rabdomiólisis, la miositis, la miocarditis y el infarto de miocardio. Debido a su distribución principalmente hepática, las elevaciones de ALT son muy útiles a la hora de detectar el daño hepático y las mediciones de ALT son especialmente útiles en el diagnóstico y gestión de una enfermedad hepática.
Aspartato aminotransferasa: presenta una elevada actividad en el corazón, el músculo esquelético y el hígado. Los aumentos de la actividad de la AST en suero se observan habitualmente después de un infarto de miocardio, embolia pulmonar, traumatismo del músculo esquelético, cirrosis alcohólica, hepatitis vírica y hepatitis inducida por fármacos.
Gamma glutamiltransferasa: desempeña un papel principal en el metabolismo del glutatión y en la reabsorción de aminoácidos del filtrado glomerular. También es importante en la absorción de aminoácidos de la luz intestinal. La GGT está presente sobre todo en el hígado, el páncreas y el riñón, aunque también se ha detectado en otros órganos aunque con una actividad menor.
La GGT sérica es un indicador sensible de enfermedad hepatobiliar y es útil en el diagnóstico de la ictericia obstructiva y de la hepatopatía alcohólica crónica, en el seguimiento de alcohólicos crónicos que están bajo tratamiento y en la detección de hepatotoxicidad. La GGT es más sensible a la obstrucción biliar que la AST, la ALT, o la ALKP. La GGT también está aumentada en el hepatoma, el carcinoma de páncreas y en el carcinoma hepático metastásico.
Colinesterasa: Existen dos tipos de colinesterasa:
- La acetilcolinesterasa, que se encuentra en los hematíes y en los tejidos nerviosos.
- La colinesterasa, que se encuentra en el plasma, el hígado, el corazón y otros tejidos.
Estas determinaciones son útiles para el diagnóstico de la intoxicación por plaguicidas, enfermedades hepáticas y sensibilidad a la administración de succinilcolina.
- Intoxicación por plaguicidas. Los plaguicidas a base de organofosfatos y carbamato son inhibidores de la colinesterasa y de la acetilcolinesterasa. Aunque su efecto tóxico se debe a la inhibición de la acetilcolinesterasa en las terminaciones nerviosas, con frecuencia la colinesterasa se usa clínicamente debido a su elevada actividad en suero y a su fácil determinación.
- Enfermedades hepáticas. La cirrosis, la hepatitis y el carcinoma hepático metastásico reducen la actividad de la colinesterasa. Las reducciones en la actividad de CHE se consideran una medida sensible del descenso de capacidad sintética del hígado, ya que habitualmente la actividad de la colinesterasa en el suero es muy alta.
- Sensibilidad a la administración de succinilcolina. La succinilcolina es un relajante muscular de acción rápida que se administra durante la cirugía. Es un inhibidor reversible de la acetilcolinesterasa que es hidrolizado por la colinesterasa sérica. Las personas cuya actividad de colinesterasa en suero es insuficiente o que presentan determinadas variantes genéticas no pueden metabolizar este fármaco con rapidez, lo que provoca una apnea prolongada. Una actividad baja de CHE puede ser crónica o transitoria como consecuencia de la exposición a plaguicidas, trastornos hepáticos, embarazos o debido al uso de anticonceptivos orales.
Creatina cinasa: llamada anteriormente creatina fosfocinasa, es una enzima celular con una amplia distribución tisular. La CK se encuentra principalmente en el músculo esquelético y cardíaco. La función fisiológica de la CK se asocia con la generación de ATP destinada a los sistemas de contracción o transporte. La cifras de CK sérica están casi siempre aumentadas después de un infarto agudo de miocardio o después de lesiones en el músculo esquelético. Esta enzima aparece comúnmente elevada en la miocarditis de cualquier origen, los accidentes cerebrovasculares, la rabdomiólisis, la polimiositis y el esfuerzo físico agudo. La CK también está aumentada en las distrofias musculares; en la distrofia muscular de Duchenne, son comunes elevaciones de CK de 20–200 veces los valores normales. Una CK baja puede ser el reflejo de una disminución de la masa muscular o emaciación muscular. Los valores de referencia correspondientes a la CK deben tener en cuenta la edad, el sexo y la actividad física de la persona. Los valores bajos de actividad de CK sérica son comunes en los ancianos, los pacientes postrados en cama y en pacientes con procesos malignos avanzados.
Creatina cinasa MB: La isoenzima MB de la creatina cinasa se encuentra fundamentalmente en el músculo cardíaco aunque también existen trazas en el músculo esquelético. Las cifras de CK-MB están aumentadas después de un infarto agudo de miocardio que es donde esta prueba encuentra su principal aplicación.
La actividad de CK-MB suele ser máxima entre 12 y 24 horas después de un infarto de miocardio, volviendo a los valores normales al cabo de 48 a 72 horas en los casos sin complicaciones. La CK-MB también está elevada en la miocarditis, en la distrofia muscular de Duchenne, la polimiositis, la rabdomiólisis y otros trastornos miocárdicos o miopáticos.
Lactato deshidrogenasa: es una enzima con una amplia distribución tisular y en concentraciones elevadas indica daño tisular. Entre las causas de una elevada LDH figuran estados neoplásicos (leucemia, linfoma, o tumores sólidos), anemia (megaloblástica o hemolítica), estados inflamatorios e infecciosos, trastornos pulmonares o musculares, infartos renales y de miocardio, hepatopatía, traumatismo y shock.
Hierro: La mayor parte del hierro se encuentra unido a la hemoglobina. La determinación del hierro sérico es útil para el diagnóstico diferencial de la anemia, la anemia secundaria por deficiencia de hierro, la talasemia, una posible anemia sideroblástica y la intoxicación por hierro.
El hierro sérico está aumentado en situaciones de hemosiderosis, anemias hemolíticas, talasemia, anemias sideroblásticas, hepatitis, necrosis hepática aguda, hemocromatosis, tratamiento con hierro inadecuado e intoxicación por hierro. El hierro sérico está disminuido en algunos casos de aporte insuficiente de hierro en la dieta, pérdida crónica de sangre, malabsorción del hierro, alteración de la liberación de las reservas de hierro (habitualmente observada en la inflamación), infección y enfermedades crónicas.
Capacidad directa de unión del hierro: La medida del hierro sérico y la capacidad de fijación del hierro sérico es útil en el diagnóstico diferencial de la anemia, la anemia por deficiencia de hierro, la talasemia, una posible anemia sideroblástica y la intoxicación por hierro. La capacidad de fijación de hierro total (TIBC) en suero, que representa la capacidad de fijación de hierro de la transferrina, es un índice útil del estado alimenticio. La TIBC sérica varía en función de los diferentes trastornos del metabolismo del hierro. La TIBC sérica es elevada en las deficiencias de hierro y baja en las enfermedades inflamatorias crónicas, las malignidades y las hemocromatosis.
Inmunoglobulina A: La IgA representa del 10 al 15% de las inmunoglobulinas del suero. A pesar de que no se conoce con exactitud el papel que juega en el suero, su intervención en la resistencia frente a las infecciones se debe a que impide la adherencia de las bacterias o a la inhibición del contacto y penetración de los virus. La IgA podría estar elevada en infecciones recurrentes y reacciones anafilácticas a una transfusión. Los aumentos también están asociados a la hepatopatía crónica, infecciones crónicas, neoplasia del tracto gastrointestinal inferior y a la enfermedad inflamatoria intestinal. La IgA también se puede utilizar como medio diagnóstico de la ataxia telangiectasia, en la diferenciación de los componentes M en el mieloma múltiple y en la evaluación de la progresión del mieloma de tipo IgA. Niveles reducidos de IgA se pueden observar en la deficiencia genética aislada, en trastornos de inmunodeficiencia combinados, mieloma múltiple de tipo no IgA o macroglobulinemia.
Inmunoglobulina G: La IgG está presente en todos los fluidos extracelulares y representa del 70 al 75% de las inmunoglobulinas del plasma en adultos. La IgG actúa protegiendo los espacios tisulares eliminando pequeñas proteínas solubles, tales como toxinas bacterianas, y favoreciendo su aclaramiento por el sistema reticuloendotelial. Pueden observarse concentraciones elevadas de IgG en infecciones recurrentes o crónicas, enfermedades autoinmunes y tumores malignos. También se pueden observar concentraciones elevadas en el lupus eritematoso sistémico, artritis reumatoide, en algunas enfermedades parasitarias y en infecciones. La forma más común de mieloma múltiple es el de tipo IgG. La deficiencia de IgG puede ser genética (por ejemplo, el síndrome de Wiskott-Aldrich, la inmunodeficiencia combinada grave) o adquirida (por ejemplo, el sida).
Inmunoglobulina M: La IgM es la primera inmunoglobulina que se sintetiza en respuesta a una provocación antigénica y representa del 5 al 10% de las inmunoglobulinas circulantes totales. El papel de la IgM en la activación de la cascada del complemento y en la estimulación de la fagocitosis la convierte en un factor importante a la hora de eliminar antígenos en forma de partículas y microorganismos de la circulación. Las concentraciones de IgM se utilizan para evaluar las proteínas monoclonales observadas en la electroforesis del suero y para controlar la progresión de la respuesta terapéutica de los pacientes con macroglobulinemia. Se observan frecuentemente concentraciones elevadas en infecciones víricas, artritis reumatoide y enfermedad hepatocelular crónica, sarcoidosis activa, macroglobulinemia de Waldenström y linfoma maligno. Se observan concentraciones bajas en asociación con infecciones recurrentes, crónicas o graves, mieloma múltiple (IgA o IgG) y enteropatía perdedora de proteínas (aunque no en el síndrome nefrótico).
Complemento C3: es la proteína más abundante del sistema del complemento. Al ser uno de los principales mediadores de la inflamación, actúa como el vínculo funcional entre la ruta clásica y la alternativa de la activación del sistema del complemento. La activación del complemento produce varios efectos biológicos, como la destrucción de agentes extraños (bacterias, levaduras, virus), la liberación de histamina y la liberación de leucocitos de la médula ósea. Las concentraciones de C3 se pueden usar como medio diagnóstico de las enfermedades vasculares hereditarias o de las enfermedades vasculares del colágeno, como la nefritis por lupus activo, infecciones graves e inflamación. Se pueden observar concentraciones elevadas tras un traumatismo o cirugía, obstrucción biliar o glomeruloesclerosis focal.
Complemento C4: es una de las enzimas activadoras del sistema del complemento. En la ruta clásica, la activación de C4 conduce a la formación de la C3 convertasa. C4 interviene en el daño e inflamación del tejido en los trastornos inmunológicos. Niveles reducidos de C4 debido a un aumento del consumo pueden encontrarse en el lupus eritematoso sistémico (SLE), el angioedema hereditario, la anemia hemolítica autoinmune y la nefritis autoinmune. Una deficiencia genética de C4 está asociada a una elevada prevalencia de enfermedad vascular autoinmune o de la enfermedad vascular del colágeno, especialmente del SLE. Como sustancia reactante en la fase aguda, en los casos de inflamación, traumatismo y necrosis tisular puede observarse un ligero aumento de su concentración.
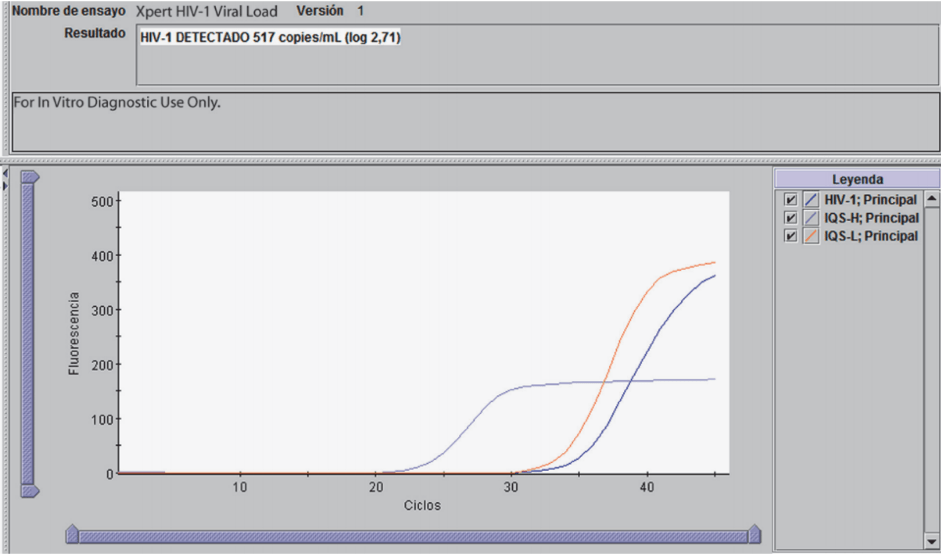
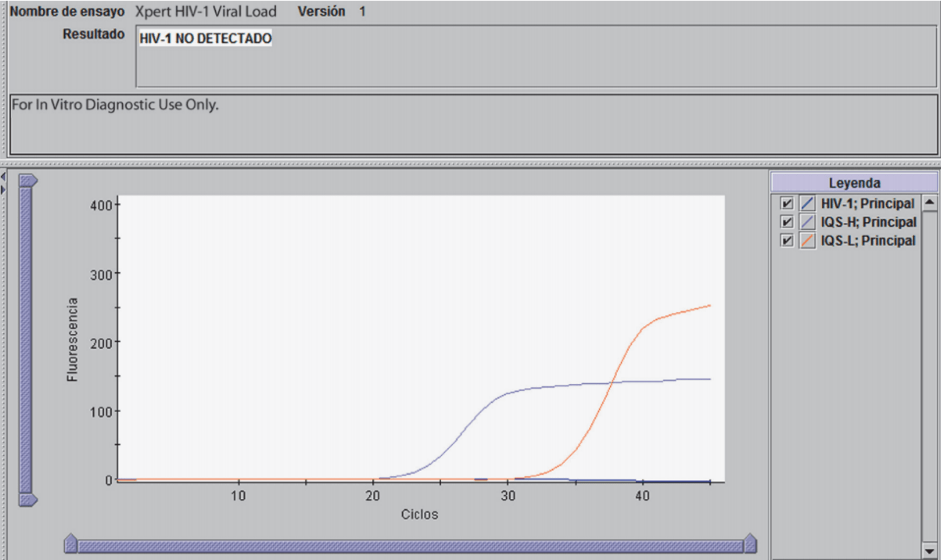
A continuación podrás visualizar un ejemplo de reporte de resultados.
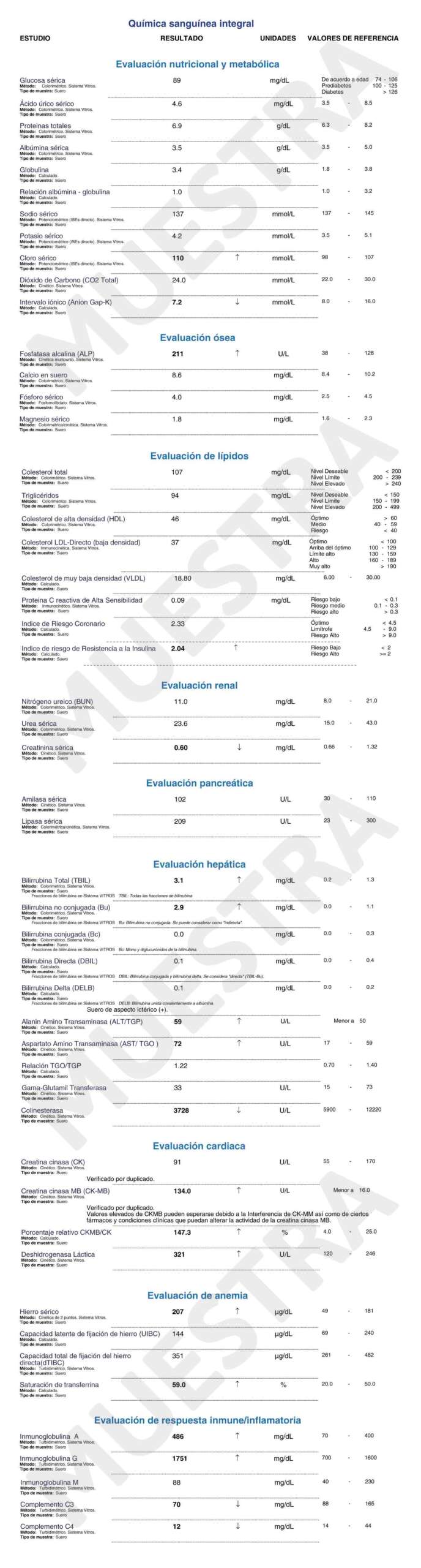
Conoce más información sobre nuestros estudios de Química Sanguínea Integral en:
www.arhlaboratorios.com/quimica_sanguinea_integral/




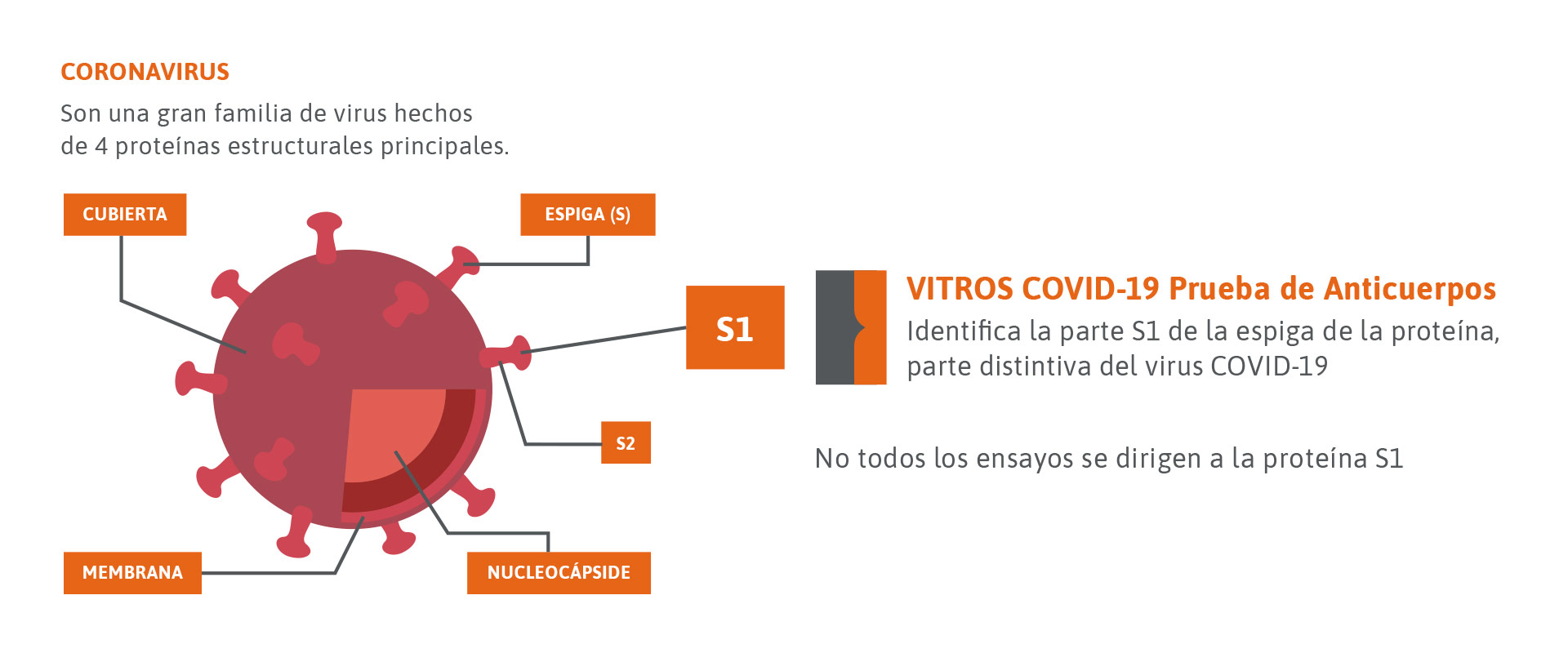
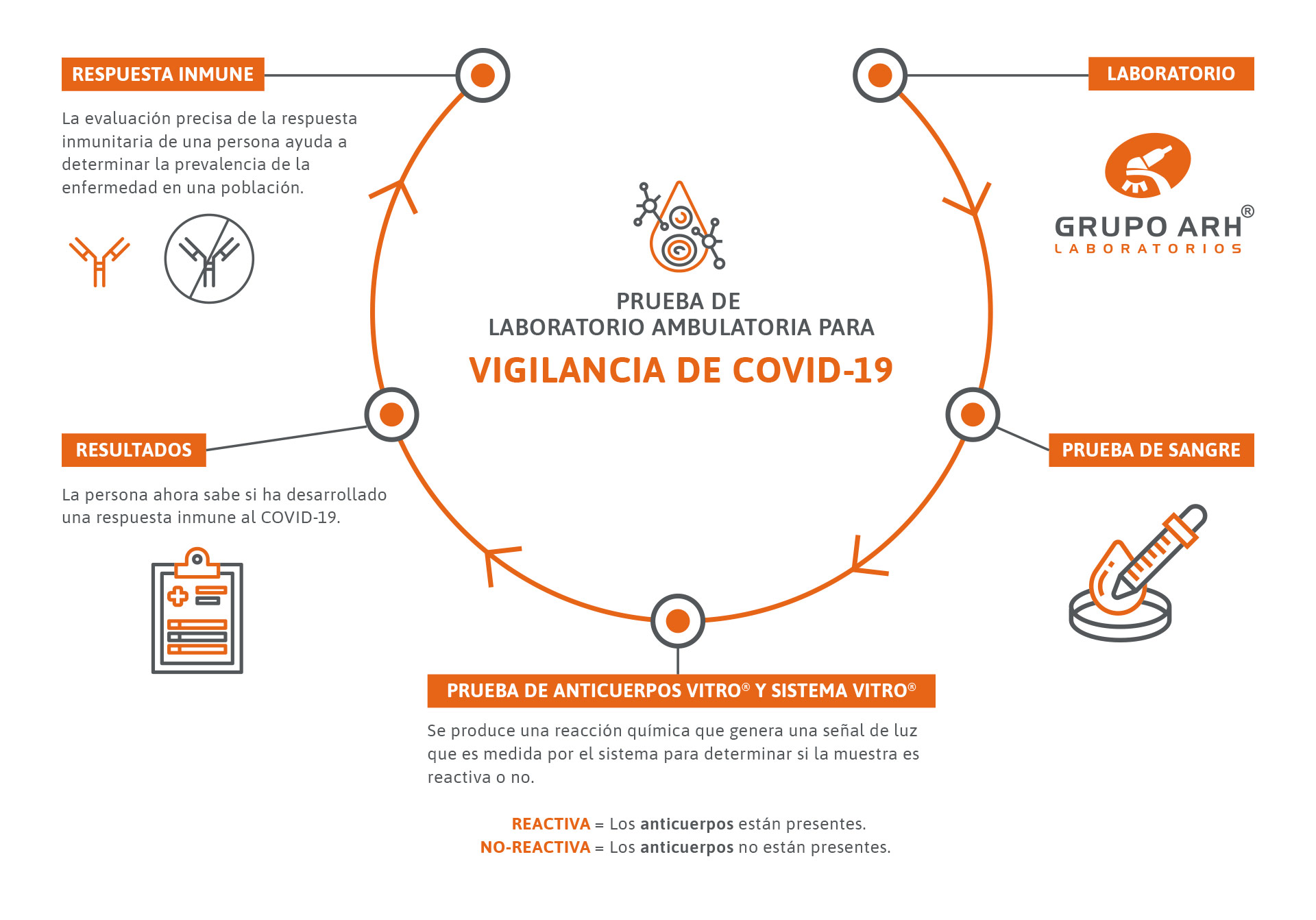



 El patógeno de las rubeolas es el virus de la rubéola, extendido por todo el mundo. Esta enfermedad se transmite a través de la infección por gotitas en el aire y ya es contagiosa durante el tiempo de incubación de dos a tres semanas. Los síntomas son dolores de cabeza, la inflamación de los ganglios linfáticos característica y, con frecuencia, el típico exantema punteado. La mayoría de las infecciones se producen entre los 5 y los 14 años, donde entre el 40 y el 50% de los casos transcurren de forma subclínica. La enfermedad de la rubéola deja una inmunidad de por vida. En Europa Central se estima una propagación de entre el 80% y el 90% en adultos. Esto equivale a entre el 10% y el 20% de las mujeres en edad fértil que no son inmunes.
El patógeno de las rubeolas es el virus de la rubéola, extendido por todo el mundo. Esta enfermedad se transmite a través de la infección por gotitas en el aire y ya es contagiosa durante el tiempo de incubación de dos a tres semanas. Los síntomas son dolores de cabeza, la inflamación de los ganglios linfáticos característica y, con frecuencia, el típico exantema punteado. La mayoría de las infecciones se producen entre los 5 y los 14 años, donde entre el 40 y el 50% de los casos transcurren de forma subclínica. La enfermedad de la rubéola deja una inmunidad de por vida. En Europa Central se estima una propagación de entre el 80% y el 90% en adultos. Esto equivale a entre el 10% y el 20% de las mujeres en edad fértil que no son inmunes. El género Bordetella (B.) comprende cuatro especies reconocidas: B. pertussis, B. parapertussis, B. bronchiseptica y B. avium. Las tres primera están tan estrechamente emparentadas genéticamente que pueden considerarse subespecies de la misma clase. B. pertussis (patógeno de la tos ferina) está extendida a escala mundial, es altamente contagiosa y se transmite entre humanos a través de la infección por gotitas en el aire. La enfermedad no está relacionada con las estaciones. Aparece de forma esporádica o epidémica. La infección deja tras de sí una inmunidad específica que, no obstante, disminuye al cabo de décadas. Se conocen las enfermedades en la edad adulta, sin embargo, no se suelen diagnosticar, a pesar de que el portador adulto puede infectar su entorno. En 2003 se enfermaron en el mundo unos 17 millones de personas de tos ferina, el 90 % de ellos en países en vías de desarrollo. En el mismo año, se registraron unos 280.000 casos mortales por tos ferina.
El género Bordetella (B.) comprende cuatro especies reconocidas: B. pertussis, B. parapertussis, B. bronchiseptica y B. avium. Las tres primera están tan estrechamente emparentadas genéticamente que pueden considerarse subespecies de la misma clase. B. pertussis (patógeno de la tos ferina) está extendida a escala mundial, es altamente contagiosa y se transmite entre humanos a través de la infección por gotitas en el aire. La enfermedad no está relacionada con las estaciones. Aparece de forma esporádica o epidémica. La infección deja tras de sí una inmunidad específica que, no obstante, disminuye al cabo de décadas. Se conocen las enfermedades en la edad adulta, sin embargo, no se suelen diagnosticar, a pesar de que el portador adulto puede infectar su entorno. En 2003 se enfermaron en el mundo unos 17 millones de personas de tos ferina, el 90 % de ellos en países en vías de desarrollo. En el mismo año, se registraron unos 280.000 casos mortales por tos ferina.