Perfil Enfermedad Celiaca (IgG e IgA)
Indicaciones
El perfil posibilita un ensayo cualitativo para la determinación in vitro de autoanticuerpos humanos de la clase de inmunoglobulina IgG e IgA contra los dos antígenos transglutaminasa tisular (tTG) y gliadina (GAF-3X) (péptido de fusión análogo a la gliadina) en suero para el diagnóstico de enteropatía sensible al gluten y dermatitis herpetiforme de Duhring.
Importancia: Para el diagnóstico de celiaquía serológico se recomienda la detección de autoanticuerpos contra transglutaminasa tisular (tTG) y contra el epítopo desaminado del péptido de gliadina (anti GAF-3X). De este modo, tanto la determinación de autoanticuerpos de la clase de inmunoglobulina A (IgA) como los de la clase de inmunoglobulina G (IgG) desempeñan un papel en caso de síndrome de deficiencia de IgA. La combinación de distintas bandas de control en el perfil sirve para la detección de la presencia de IgA para excluir una síndrome de deficiencia de anticuerpos.
Significación clínica
La detección serológica de anticuerpos específicos de la enfermedad (IgA e IgG) es un componente esencial del diagnóstico de la enteropatía sensible al gluten (celiaquía, esprue endémico) y está igualmente indicado para la evaluación de la evolución de la enfermedad y del éxito del tratamiento.
La celiaquía es una enfermedad autoinmune sistémica con marcada predisposición genética, que en las personas afectadas se manifiesta como reacción a la ingestión de gluten. El gluten es una denominada glicoproteína, una mezcla de proteínas presente en diversos cereales (p. ej. trigo, cebada, centeno). La proteína más importante para la aparición de una celiaquía es la gliadina.
La prevalencia de las enfermedades celíacas en Europa se estima en aprox. un 1%. Sin embargo, los síntomas atípicos o leves se traducen presumiblemente en un mayor número de otros casos no diagnosticados. El cuadro clínico abarca, además de la típica inflamación de la mucosa del intestino delgado, síntomas tales como fatiga, borborigmo, dolor abdominal y diarrea, así como pérdida de peso, anemia, problemas de fertilidad, infantilismo y osteoporosis como consecuencia de la malabsorción de alimentos. En algunos pacientes se observa además una dermatitis herpetiforme de Duhring, una enfermedad cutánea que cursa con aparición de ampollas. Entre las manifestaciones atípicas de la celiaquía se cuentan también síntomas neurológicos como la ataxia por gluten. En la aparición de la celiaquía están implicados componentes genéticos como factores ambientales: la gliadina ingerida con los alimentos solo puede digerirse parcialmente en el intestino. En los pacientes celíacos, los péptidos de la gliadina remanentes pueden atravesar el epitelio del intestino delgado y llegar al tejido conjuntivo subyacente. Allí, los fragmentos de proteína son desamidados por la enzima transglutaminasa tisular (tissue transglutaminase, tTG), de modo que el aminoácido glutamina se transforma en ácido glutámico. En caso de predisposición genética (antígenos de leucocito humanos (HLA)-DQ2 o DQ8), estos péptidos modificados son ofrecidos en mayor cantidad al sistema inmunitario por células presentadoras de antígenos. Como consecuencia se segregan citoquinas proinflamatorias y se producen anticuerpos tanto contra epítopos de gliadina desamidados como contra la enzima tTG propia del organismo. Las reacciones inmunitarias conducen a la inflamación y la lesión de la mucosa del intestino delgado, identificable histológicamente por una estructura de vellosidades atrófica y criptas intestinales hiperplásicas. La clasificación según Marsh divide la celiaquía en tres tipos en función de la gravedad de esta histopatología intestinal:
- Marsh tipo I: Proliferación de linfocitos intraepiteliales (>40 LIE/100 células epiteliales) con arquitectura normal de la mucosa.
- Marsh tipo II: Hiperplasia adicional de las criptas con vellosidades todavía normales
- Marsh tipo III: Proliferación de LIE, hiperplasia de las criptas, degeneración de las células epiteliales y deformación de las vellosidades. El tipo III se subdivide, a su vez, en Marsh IIIA (atrofia parcial de las vellosidades), Marsh IIIB (atrofia subtotal de las vellosidades) y Marsh IIIC (atrofia total de las vellosidades).
El diagnóstico serológico, como método económico y no invasivo, contribuye decisivamente al diagnóstico y la monitorización de la celiaquía y convierte en imprescindible una biopsia del intestino delgado en determinadas circunstancias.
La detección de los anticuerpos contra tTG (IgA e IgG) se lleva a cabo mediante un sistema de ensayo monoespecífico. En especial los anticuerpos IgA contra tTG están considerados como los indicadores más específicos y sensibles de la celiaquía. Los también sumanente específicos y sensibles anticuerpos IgA contra endomisio (EmA) pueden determinarse mediante el ensayo de inmunofluorescencia utilizando secciones tisulares del esófago (primate), del intestino (primate) o del hígado (primate).
Para el control de la evolución y la monitorización de una dieta sin gluten en el curso de un tratamiento, las reacciones antígeno-anticuerpo también proporcionan información valiosa. La disminución de los títulos de anticuerpos sugiere el éxito del tratamiento y por regla general va asociada a una mejora de los síntomas clínicos.
En 2012 se publicó una sinopsis de las nuevas Directivas de la ESPGHAN (European Society for Paediatric Gastroenterology, Hepatology, and Nutrition) europeas para el diagnóstico de la celiaquía en niños y jóvenes. Dichas directivas diferencian en el procedimiento diagnóstico entre pacientes cuyos síntomas clínicos sugieren una celiaquía y las personas asintomáticas que tienen un riesgo elevado de padecer celiaquía.
Niños y jóvenes con síntomas de la enfermedad (p. ej. molestias gastrointestinales, infantilismo, osteoporosis, anemia; es probable el diagnóstico de celiaquía)
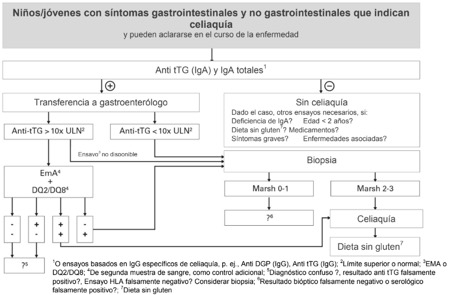
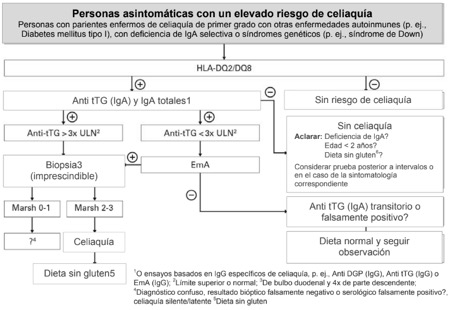
Pacientes sin síntomas específicos de la enfermedad (riesgo genético de celiaquía, riesgo elevado de celiaquía en caso de p. ej. parientes de primer grado de pacientes celíacos, personas con diabetes mellitus de tipo I, síndrome de Down)
Referencias bibliográficas
- Fasano A. Celiac disease – how to handle a clinical chameleon. N Engl J Med (2003) 348:25.
- Felber J, Aust D, Baas S, Bischoff S, Bläker H, Daum S, Keller R, Koletzko S, Laass M, Nothacker M, Roeb E, Schuppan D, Stallmach A. Ergebnisse einer S2k-Konsensuskonferenz der Deutschen Gesellschaft für Gastroenterologie, Verdauungs- und Stoffwechselerkrankungen (DGVS) gemeinsam mit der Deutschen Zöliakie-Gesellschaft
(DZG) zur Zöliakie, Weizenallergie und Weizensensitivität. Z Gastroenterol (2014) 52: 711-
743. - Husby S., Koletzko S, Korponay-Szabó IR, Mearin ML, Phillips A, Shamir R, Troncone R, Giersiepen K, Branski D, Catassi C, Lelgeman M, Mäki M, Ribes-Koninckx C, Ventura A, Zimmer KP; ESPGHAN Working Group on Coeliac Disease Diagnosis; ESPGHAN Gastroenterology Committee; European Society for Pediatric Gastroenterology, Hepatology, and Nutrition. European Society for Pediatric Gastroenterology, Hepatology, and Nutrition guidelines for the diagnosis of coeliac disease. J Pediatr Gastroenterol Nutr 54 (2012) 136-160.
- Mustalahti K, Catassi C, Reunanen A, Fabiani E, Heier M, McMillan S, Murray L, Metzger MH, Gasparin M, Bravi E, Mäki M; Coeliac EU Cluster, Project Epidemiology. The prevalence of celiac disease in Europe: results of a centralized, international mass screening project. Ann Med (2010) 42(8):587-95.
- Prause C, Richter T, Koletzko S, Uhlig HH, Hauer AC, Stern M, Zimmer K-P, Laass MW, Probst C, Schlumberger W, Mothes T. New developments in serodiagnosis of childhood celiac disease. Assay of antibodies against deamidated gliadin. Ann N Y Acad Sci (2009) 1173: 28-35.
- Prause C, Ritter M, Probst C, Daehnrich C, Schlumberger W, Komorowski L, Lieske R, Richter T, Hauer AC, Stern M, Uhlig HH, Laass MW, Zimmer K-P, Mothes T. Antibodies against deamidated gliadin as new and accurate biomarkers of childhood coeliac disease. J Pediatr Gastroenterol Nutr (2009) 49(1): 52-58.
- Richter T, Bossuyt X, Vermeersch P, Uhlig HH, Stern M, Hauer A, Zimmer K-P, Mearin L, Roo de JHC, Dähnrich C, Mothes T. Determination of igg and iga antibodies against native gliadin is not helpful for the diagnosis of coeliac disease in children up to 2 years old. J Pediatr Gastroenterol Nutr (2012) 55(1): 21-25.
- Schwertz E, Kahlenberg F, Sack U, Richter T, Stern M, Conrad K, Zimmer K-P, Mothes T. Serologic assay based on gliadin-realted nonapeptides as a highly sensitive and specific diagnostic aid in celiac disease. Clin Chem (2004) 50(12): 2370-2375.
- Villalta D,Tonutti E, Prause C, Koletzko S, Uhlig HH, Vermeersch P, Bossuyt X, Stern M, Laass MW, Ellis JH, Ciclitira PJ, Richter T, Daehnrich C, Schlumberger W, Mothes T. IgG antibodies against deamidated gliadin peptides for diagnosis of celiac disease in patients with iga deficiency. Clin Chem (2010) 56:3.
- Wolf J, Hasenclever D, Petroff D, Richter T, Uhlig HH, Laaß MW, Hauer A, Stern M, Bossuyt X, Laffolie de J, Flemming G, Villalta D, Schlumberger W, Mothes T. Antibodies in the diagnosis of coeliac disease: a biopsy-controlled, international, multicentre study of 376 children with coeliac disease and 695 controls. PLoS ONE (2014) 9(5): e97853. doi:10.1371/journal.pone.0097853.

