
 *Anticuerpos antinucleares por inmunofluorescencia
*Anticuerpos antinucleares por inmunofluorescencia
La inmunofluorescencia indirecta es el patrón oro para la determinación de anticuerpos contra antígenos nucleares (ANA, incluidos componentes del citoplasma). La tecnología BIOCHIP permite la combinación de varios sustratos en un pocillo de ensayo (ensayo Multiplex) para la incubación de un suero de paciente. La combinación de sustrato de células HEp-2 o HEp-20-10 con tejido hepático de primate y/o dots monoespecíficos (EUROPLUS: SS-A, SS-B, Jo-1, Scl70, nRNP/Sm, Sm, proteína P rib.) posibilita ya durante el cribado para ANA la confirmación y diferenciación de los resultados, así como, en algunos casos, la obtención de resultados adicionales.
Los anticuerpos antinucleares son inmunoglobulinas que reconocen componentes celulares autólogos (nucleares y citoplasmáticos). Además de los ANA autoinmunes, pueden estar en circulación ANA infecciosos y naturales.
La detección de ANA debe realizarse mediante inmunofluorescencia indirecta (IFI) en líneas celulares como prueba de tamizado inicial debido a su alta sensibilidad. Una muestra positiva para ANA, detectados mediante IFI, debe confirmarse mediante técnicas más sensibles y específicas como Blot (anticuerpos antinucleares diferenciado).
Los ANA detectados por IFI deben ser evaluados en base al patrón y al título. Una lectura negativa de ANA significa que no hay autoanticuerpos presentes. Sin embargo, una lectura positiva de ANA no indica que haya una enfermedad autoinmunitaria.

Entre los principales patrones de fluorescencia se cuentan la fluorescencia nuclear homogénea y granular, así como coloraciones de los nucléolos y de los centrómeros (claramente identificable especialmente en las células en mitosis).
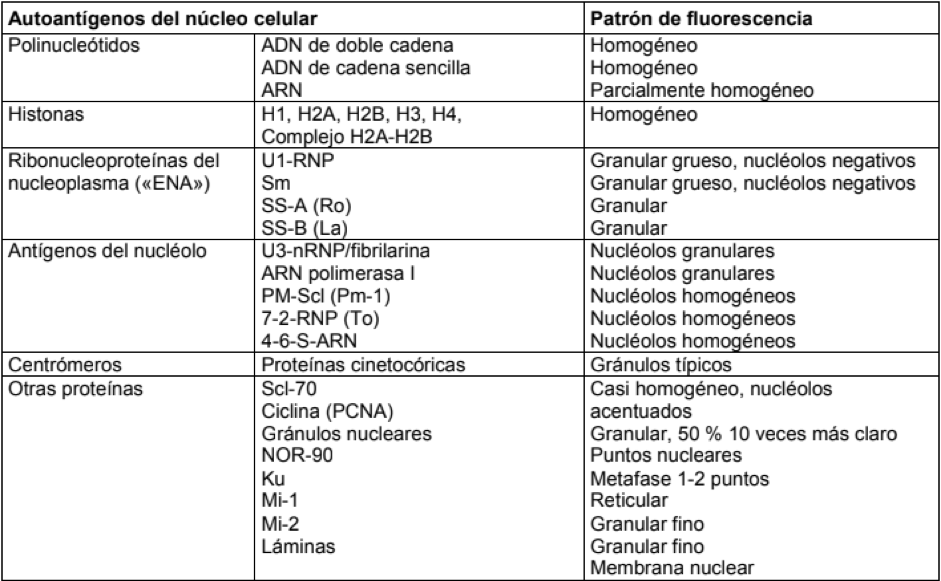
*Anticuerpos anti DNA por inmunofluorescencia
El sustrato estándar para la prueba de inmunofluorescencia es el hemoflagelado tardío Crithidia luciliae. Este posee una mitocondria gigante que contiene dsDNA (cinetoplasto) que, aparte del dsDNA, esencialmente no muestra antígenos que también se producen en el núcleo celular. Por lo tanto, los anticuerpos que reaccionan con el cinetoplasto se dirigen exclusivamente al ADNds. Con C. luciliae producen una fluorescencia homogénea, parcialmente acentuada por el borde del cinetoplasto. No se evalúa ninguna reacción en el núcleo celular; La fluorescencia en el cuerpo basal de la luz del flúor no tiene significación. Los anticuerpos contra el ADNss no pueden teñir el cinetoplasto.
Asociación clínica: los autoanticuerpos contra dsDNA se encuentran exclusivamente en el LES y en el 40-90% de los casos, según el método de investigación y la actividad de la enfermedad.
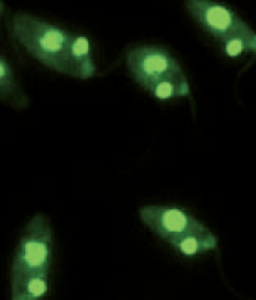
*Ac. Anti Citoplasma de neutrófilos (C-ANCA y P-ANCA)
Los ANCA son autoanticuerpos (aAc) contra antígenos principalmente localizados en los gránulos citoplasmáticos de monocitos y granulocitos neutrófilos. Los ANCA, que en el IFI presentan una fluorescencia granular distribuida regularmente por todo el citoplasma a excepción del núcleo celular se denominan cANCA (patrón citoplasmático), mientras que los que en el IFI presentan una fluorescencia predominantemente lisa, parcialmente granular fina enrollada en forma de cinta alrededor del núcleo celular de los granulocitos, pANCA (patrón perinuclear). Son posibles los patrones de fluorescencia de cANCA y pANCA atípicos.
Los antígenos asociados a los ANCA incluyen:
- La enzima mieloperoxidasa (MPO), principalmente asociada a los pANCA,
- La proteinasa 3 (PR3), principalmente asociada a los cANCA,
- El antígeno de colágeno de tipo IV (proteína de la matriz extracelular del la membrana basal glomerular (MBG).
Las vasculitis/enfermedades autoinmunes asociadas a los ANCA de los vasos pequeños son:
- Granulomatosis poliangitis (GPA), anteriormente denominada granulomatosis de Wegner (WG),
- Poliangitis microscópica (MPA),
- Granulomatosis eosinófila con poliangitis (de Wegener) (EGPA), anteriormente denominada síndrome de Churg-Strauss (CSS),
- Vasculitis de inmunocomplejo,
- Glomerulonefritis anti-membrana basal (glomerulonefritis anti-MBG),
- Síndrome de Goodpasture (avance rápido de glomerulonefritis anti-MBG con hemorragias pulmonares).
Las vasculitis asociadas a los ANCA se caracterizan por un riego sanguíneo insuficiente de los órganos debido a una inflamación necrosante de los vasos, formación de microaneurismas y hemorragias en la zona de los vasos sanguíneos destruidos. Dado que los métodos diagnósticos de imagenología e histológicos para la detección o la exclusión de una vasculitis de los vasos pequeños, así como la evaluación de la actividad inflamatoria y el desarrollo de la enfermedad, tienen un valor diagnóstico con restricciones, la determinación de ANCA serológica cualitativa y cuantitativa contribuye de forma decisiva al diagnóstico. En general, al comienzo de la enfermedad los niveles de ANCA son altos, después disminuyen durante el tratamiento y pueden volver a aumentar más tarde, lo que no tiene que estar relacionado con una recidiva.

*Ac. anti Mitocondria/Músculo liso
AMA
El ensayo sirve para la detección serológica de autoanticuerpos contra mitocondrias (AMA).
Estos suelen estar asociados a la enfermedad autoinmune colangitis biliar primaria (CBP) y revisten gran importancia como marcadores inmunológicos para el diagnóstico de esta grave enfermedad.
La CBP es una colangitis destructiva crónica, no supurativa que provoca la destrucción inflamatoria progresiva de los conductos biliares pequeños y cuyo cuadro final es la cirrosis hepática. Afecta entre un 80% y un 90% de los casos a las mujeres de entre 20 y 60 años y, en casos aislados, también a los niños.
Los síntomas de la CBP son inicialmente poco característicos. Aparecen estados de fatiga y agotamiento, así como prurito intenso. Estos síntomas pueden preceder en meses o años a un incremento de los valores hepáticos y al diagnóstico de una CBP. Finalmente, como consecuencia de la colestasa aparecen alteraciones cutáneas en forma de xantelasmas en las comisuras palpebrales interiores, déficit de vitaminas A, D, E y K, esteatorrea y posiblemente una osteoporosis. No es necesaria una biopsia hepática para establecer el diagnóstico, si bien es aconsejable para determinar la actividad y el estadio de la CBP:
- Estadio I: reacción inflamatoria de los denom. campos de portal
- Estadio II: necrosis adicionales
- Estadio III: formación de septos de tejido conjuntivo
- Estadio IV: alteración cirrótica del tejido hepático (en aprox. un 6%, riesgo incrementado de aparición de un carcinoma hepatocelular)
En el estadio final de la CBP (estadio de cirrosis descompensada), el trasplante de hígado es la única medida que puede salvar la vida. En aprox. el 75% de los pacientes trasplantados, esto cura la CBP. En el resto de pacientes, tras el trasplante se desarrolla una recidiva de CBP, si bien progresa muy lentamente.
En paralelo al diagnóstico clínico de una CBP, el examen por ultrasonidos puede proporcionar indicios adicionales, si bien durante el estadio temprano el hígado puede aparecer normal o similar a un hígado graso y en estadios más avanzados está hipertrofiado. En el estadio final de la cirrosis, se reduce el tamaño del hígado, con una superficie casi siempre irregular u ondulada.
Dado que ni el cuadro clínico ni los métodos de obtención de imágenes permiten el diagnóstico concluyente de la CBP, adquiere especial importancia el diagnóstico serológico de la CBP. Los AMA pueden detectarse mediante IFI con diversos sustratos histológicos y células HEp-2, siendo las criosecciones de riñón de rata el sustrato estándar. Esta prueba permite la detección de autoanticuerpos contra AMA como indicio claro de una CBP, con un alto grado de especificidad y sensibilidad.
La relevancia diagnóstica de la detección de AMA puede incrementarse sensiblemente en un segundo paso mediante mosaico IIFT, ELISA o Westernblot. Para ello se lleva a cabo una diferenciación de AMA en los distintos tipos de AMA, de los cuales M2, M4, M8 y M9 presentan en términos generales la mayor especificidad para CBP, con una prevalencia de casi el 100%. Con la detección AMA como cribado y la detección de tipos de AMA como confirmación se obtiene la máxima certeza diagnóstica posible.
GMA, ASMA
Los autoanticuerpos contra músculos lisos (GMA, ASMA) aparecen en diversas enfermedades hepáticas (hepatitis crónica, cirrosis hepática). Su determinación reviste importancia especialmente para el diagnóstico de una hepatitis autoinmune (lupoide) activa crónicamente. Los anticuerpos GMA también pueden estar presentes en la mononucleosis infecciosa y en otras infecciones víricas, así como en el lupus eritematoso sistémico, los carcinomas mamarios y ováricos y los melanomas malignos, pero en estos casos no desempeñan ningún papel diagnóstico. Tras una hepatitis vírica, por regla general el título vuelve a disminuir muy rápidamente.
Las concentraciones elevadas de anticuerpos contra músculos lisos sugieren una hepatitis activa crónicamente (HAC), y su prevalencia es del 70%. Los títulos de IgG e IgM pueden estar en correlación con la actividad de la enfermedad. La HAC aparece predominantemente en mujeres, y la mitad de los casos se manifiestan antes de los 30 años. En el 40% de los casos, la enfermedad empieza con una hepatitis aguda. Las biopsias de hígado revelan necrosis de las células parenquimales con infiltraciones de linfocitos y células plasmáticas.
Por medio de los autoanticuerpos y de diversos parámetros de virus, es posible clasificar la hepatitis crónica en subgrupos etiológicamente distintos. En la HAC a menudo se detectan, además de anticuerpos contra músculos lisos, autoanticuerpos contra núcleos celulares, mitocondrias, ADNs y citoplasma de granulocitos (pANCA).
También se observan títulos de GMA bajos en pacientes con colangitis biliar primaria (50%), cirrosis inducida por alcohol, obstrucción de los conductos biliares y en aprox. el 2% de las personas de apariencia sana.

Nombre: Ac. Anti Nucleares por Inmunofluorescencia (IFI)
Código: ANAIF
Método: Inmunofluorescencia indirecta.
Muestra: Suero 2 mL
Tiempo de entrega: 1 DH
Nombre: Ac. Anti DNA por inmunofluorescencia
Código: DNAIF
Método: Inmunofluorescencia indirecta.
Muestra: Suero 2 mL
Tiempo de entrega: 1 DH
Nombre: Ac. Anti Citoplasma de neutrófilos (C-ANCA y P-ANCA)
Código: ANCAS
Método: Inmunofluorescencia indirecta.
Muestra: Suero 2 mL
Tiempo de entrega: 1 DH
Nombre: Ac. Anti Mitocondria/Músculo liso
Código: MITOC
Método: Inmunofluorescencia indirecta.
Muestra: Suero 2 mL
Tiempo de entrega: 1 DH






Aún no hay comentarios, ¡añada su voz abajo!