Blastocystis hominis ha sido considerado un esporozoo de acuerdo a sus características morfológicas, de cultivo y modo de división, un protozoo flagelado, un hongo, etc. Su ubicación taxonómica es incierta pero su estudio se realiza en la mayoría de los manuales con las amebas. Su patogenicidad es discutida pero los hallazgos anatomopatológicos intestinales avalan su implicación en el cuadro denominado blastocistosis.
CLASIFICACIÓN/TAXONOMÍA
La taxonomía de Blastocystis hominis es muy controvertida y sometida a continuos cambios. Actualmente, de acuerdo a estudios de la secuencia completa del ssrRNA, se considera su inclusión entre las estramenofilas un grupo de seres vivos heterogéneo en el que están ubicados protistas uni y multicelulares, heterótrofos y fotosintéticos y que da cabida a diatomeas, algas pardas, crisofitos, etc. Cavalier-Smith (1998) en una revisión de la clasificación en 6 reinos propone su ubicación en el reino Chromista. De acuerdo a esta clasificación Blastocystis spp. es el primer y único cromista patógeno para el hombre.
Dominio Eukaryota Reino Chromista
Subreino Chromobiota
Infrareino Heterokonta (superponible a las estremofilas)
Subfilo Opalinata Clase Blastocystea
Orden Blastocystida
Género Blastocystis Alexeev, 1911
Otras clasificaciones, contempladas en muchos libros y manuales lo incluyen en:
Dominio Eukaryota Reino Protozoa
Subreino Biciliata Infrareino Alveolata
Filo Myzozoa
Subfilo Apicomplexa
Clase Blastocystea Género Blastocystis
MORFOLOGÍA
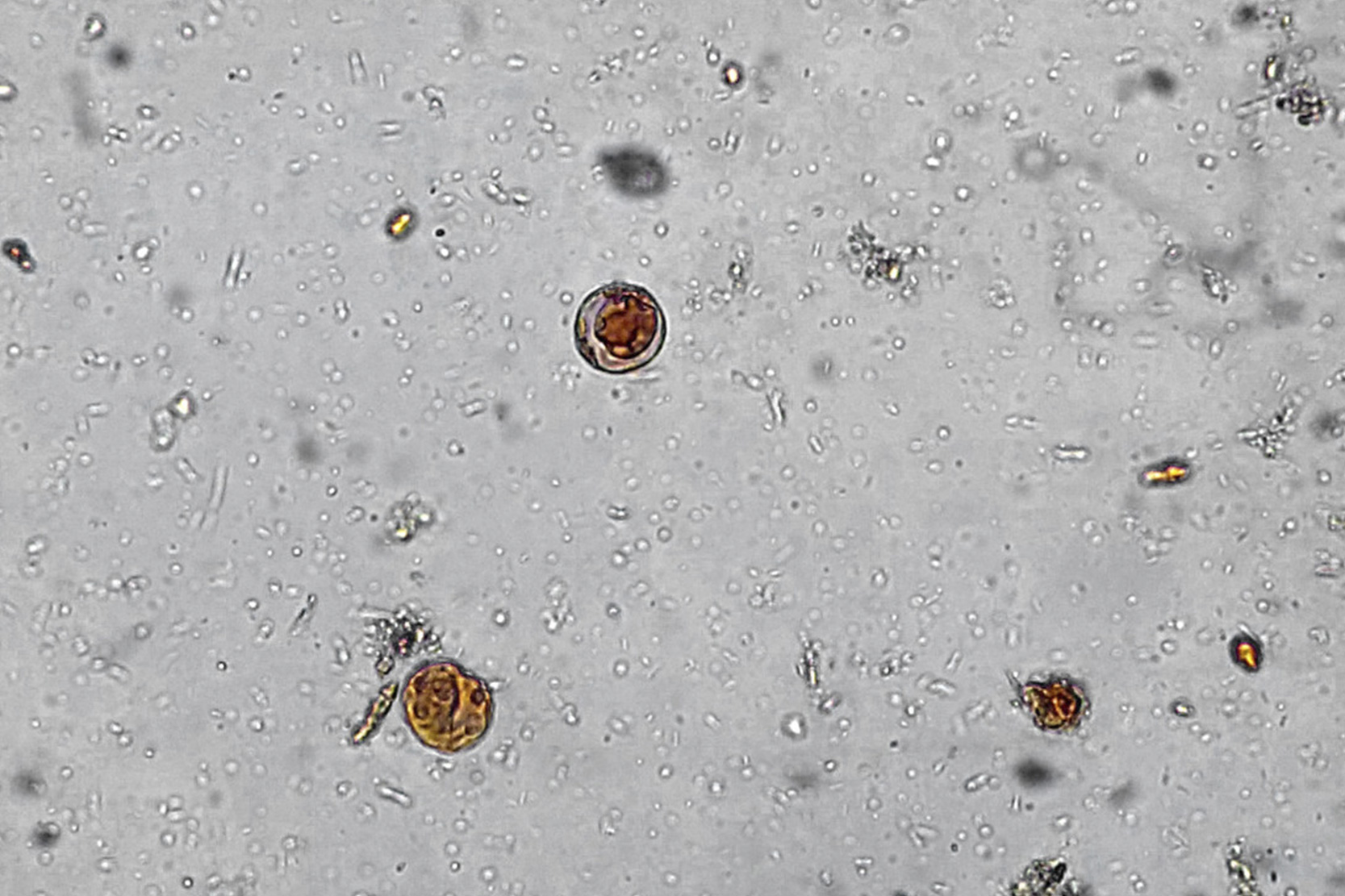
B. hominis es un organismo polimórfico. Están descritas cuatro formas morfológicas diferentes: vacuolar, granular, ameboide y quistica. Además se han observado otras morfologías entre las que destacan las formas avacuolares y multivacuolares que posiblemente son fases intermedias. La forma vacuolar tiene un tamaño muy variable, entre 2-200 μm de diámetro con una media de 4-15 μm y se caracteriza por la presencia de una gran vacuola central, implicada en el almacenamiento de carbohidratos y lípidos, que ocupa aproximadamente el 90% del volumen celular. En la periferia se encuentran el citoplasma con mitocóndrías, aparato de Golgi y retículo endoplasmático y varios núcleos (generalmente más de 6). Esta forma predomina en las heces frescas y puede observarse en los cultivos.
Formas vacuolares de Blastocystis hominis
La forma granular parece proceder de la transformación de la vacuolar por diferentes estímulos como concentración de suero en medios de cultivo, subcultivo, presencia de antibióticos, etc. Es morfológicamente similar a la forma vacuolar pero el citoplasma circundante o la vacuola (más frecuentemente) están finamente granulados.
La naturaleza y función de los gránulos es controvertida. Se piensa que la vacuola central puede estar implicada en la división esquizogónica y que los gránulos no serían más que la progerie de la célula inicial.
La forma ameboide es polimorfa, capaz de emitir pseudópodos por extensión y retracción y con una marcada actividad fagocitaria demostrada por la presencia de restos bacterianos y celulares en su interior. En este sentido se ha sugerido que es una fase intermedia entre la forma vacuolar y la quística y estaría encargada de la fagocitosis para obtener energía para la enquistación Es la forma predominante en los cultivos fundamentalmente si las heces proceden de pacientes sintomáticos por lo que se especula que puede ser un indicador de patogenicidad o contribuir a la patogenicidad de Blastocystis hominis.
La forma quística se ha descrito hace pocos años posiblemente debido a que su pequeño tamaño (3-5 μm) y apariencia hacían considerarlos como artefactos. Existen 2 tipos de quistes: fecales (forma infectante, transmisible) o de pared gruesa y quistes de pared fina responsables de la autoinducción.
Los quistes fecales son esféricos u ovoides y están protegidos por para pared multilaminar. Poseen de 1 a 4 núcleos, múltiples vacuolas y depósitos lipídicos y de glucógeno. Están rodeados por una capa fibrilar independiente que parece producida por el organismo cuando madura.
EPIDEMIOLOGÍA
Es de distribución universal con mayor prevalencia en regiones tropicales y ligada a un inadecuado saneamiento ambiental. La prevalencia de la infección es muy elevada, sobre todo en personas en contacto con animales y en pacientes con SIDA, pero las tasas reales de infección son desconocidas ya que habitualmente es asintomática.
El reservorio está constituido por el hombre y otros primates, cerdos, conejos, caballos, etc.
La transmisión se realiza por vía fecal-oral directa (persona-persona) o indirecta a través del agua o alimentos contaminados. Se ha postulado la transmisión a través de prácticas sexuales de riesgo.
Los quistes pueden sobrevivir a temperatura ambiente más de 20 días pero son sensibles a las temperaturas extremas y a los desinfectantes habituales.
CICLO BIOLÓGICO
El ciclo vital de B. hominis es controvertido y poco conocido. La infección se adquiere tras la ingestión de quistes fecales de pared gruesa (forma infectante). Éstos infectan las células epiteliales del tracto digestivo y se multiplican asexualmente dando lugar a la aparición de formas vacuolares que se diferenciarán a formas multivacuolares y ameboides. Las formas multivacuolares tras un estado de pre-quiste dan lugar a la formación de quistes de pared fina responsables de la autoinfección y, por tanto, del mantenimiento de la colonización. Las formas ameboides tras una división esquizogónica se diferencian a quistes de pared gruesa que son eliminados por las heces
Ciclo biológico de Blastocystis hominis
ACCIÓN PATÓGENA
La infección por B. hominis, denominada blastocistosis, es asintomática en la mayoría de los casos. Las formas sintomáticas se manifiestan generalmente como una diarrea acompañada de síntomas intestinales inespecíficos (dolor abdominal, flatulencia, nauseas…). En muchos casos el cuadro es autolimitado pudiendo erradicarse al parásito o permanecer como portador asintomático. En pacientes inmunodeprimidos los síntomas pueden ser progresivos y más pronunciados y existe una mayor tendencia a la cronicidad.
DIAGNÓSTICO PARASITOLÓGICO
El diagnóstico es directo y se basa en la detección microscópica de quistes y/o formas vacuolares en heces. Las formas vacuolares se observan con menor frecuencia si se utilizan técnicas de concentración debido a su mayor labilidad.
El cultivo en medios como el de Jones supone un incremento de la sensibilidad. No se realiza de forma rutinaria en todos los laboratorios clínicos. La forma observada con mayor frecuencia es la ameboide.
El diagnóstico indirecto basado en la detección de anticuerpos mediante técnicas de ELISA no suele utilizarse de forma rutinaria.
Pleomorfismo de Blastocystis hominis
TRATAMIENTO ANTIPARASITARIO
El tratamiento sólo está indicado si la diarrea es persistente, no consigue aislarse otro patógeno y el número de parásitos presentes en las heces es elevado. Se establece con metronidazol.
PREVENCIÓN
La prevención pasa por:
a) Evitar diseminación de quistes: tratamiento adecuado de excretas, control de basuras, control de insectos
b) Educación sanitaria: higiene personal y manipulación de alimentos correcta, identificación de reservorios
c) Evitar conductas sexuales de alto riesgo
d) Evitar contaminación del agua: Es fundamental la mejora de infraestructuras y el tratamiento correcto de aguas de consumo y residuales.
Los viajeros a zonas endémicas con saneamiento inadecuado de aguas y excursionistas deben purificar el agua con una solución saturada de yodo (12,5 ml/l) o con halozona (5 tabletas/l) durante 30 minutos o proceder al hervido.
e) Evitar tomar alimentos crudos que puedan haber sido regados o lavados con agua contaminada.
REFERENCIAS
Garcia. L.S., Bruckner D.A. Diagnostic Medical Parasitology. 1996. ASM Press; 3rd edition.
Garcia L.S. Practical Guide to Diagnostic Parasitology. 1999. ASM Press
Leelayoova S, Taamasri P, Rangsin R, Naaglor T, Thathaisong U, Mungthin M. In-vitro cultivation: a sensitive method for detecting Blastocystis hominis. Ann Trop Med Parasitol. 2002; 96: 803-807.
Leelayoova S, Rangsin R, Taamasri P, Naaglor T, Thathaisong U, Mungthin M. Evidence of waterborne transmission of Blastocystis hominis. Am J Trop Med Hyg. 2004; 70: 658-662.
Tan KS, Singh M, Yap EH. Recent advances in Blastocystis hominis research: hot spots in terra incognita. Int J Parasitol. 2002; 32: 789-804.
Tan KS. Blastocystis in humans and animals: new insights using modern methodologies.Vet Parasitol. 2004; 126:121-144.
Tan TC, Suresh KG. Predominance of amoeboid forms of Blastocystis hominis in isolates from symptomatic patients. Parasitol Res. 2006; 98: 189-193.
Tan TC, Suresh KG. Amoeboid form of Blastocystis hominis-a detailed ultrastructural insight. Parasitol Res. 2006; 99: 737-742.
Suresh K, Smith H. Comparison of methods for detecting Blastocystis hominis. Eur J Clin Microbiol Infect Dis. 2004; 23: 509-511.










Aún no hay comentarios, ¡añada su voz abajo!