

Indicaciones:
El ensayo sirve para la determinación in vitro cualitativa de autoanticuerpos humanos de la clase de inmunoglobulina IgG e IgM contra los cinco antígenos del Virus Epstein Barr ACV gp125, ACV p19, EBNA-1, p22 y EA-D en suero o plasma para el diagnóstico de infecciones con virus Epstein-Barr (mononucleosis infecciosa, síndrome de Burkitt, carcinoma nasofaríngeo).
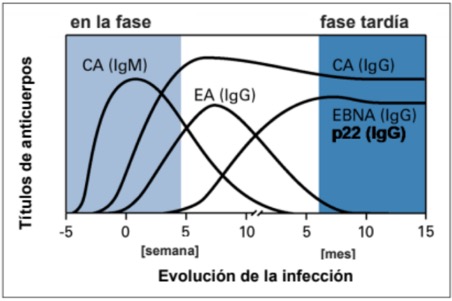
Evolución temporal de la formación de anticuerpos:
Significación clínica:
El Virus de Epstein Barr (VEB) pertenece a los herpesvirus patogénicos para los humanos más extendidos. El contagio se produce mediante una infección por contacto, aunque también puede ser a través de una transfusión sanguínea o el trasplante de un órgano. El VEB es el patógeno de la mononucleosis infecciosa (enfermedad de Pfeiffer), una enfermedad febril que por lo general aparece acompañada de una faringitis y una linfadenopatía, a menudo también de una hepatoesplenomegalia, en raras ocasiones con exantema. Cuando la infección se produce en la infancia, la mayoría de ocasiones evoluciona de forma asintomática. En los países industrializados se infectan sobre todo los jóvenes o los adultos jóvenes, en los que la enfermedad se manifiesta con frecuencia. Una infección por VEB también está relacionada con la patogénesis de linfomas malignos (p. ej., forma endémica del linfoma de Burkitt en África) y del carcinoma nasofaríngeo (CNF, extendido sobre todo en el Sudeste Asiático). El CNF es el tercer tipo de tumor más frecuente entre los tumores malignos en el sur de China. Desde 2011 aumentan las pruebas que demuestran que una infección por VEB constituye un riesgo elevado de brote o el agravamiento de una esclerosis múltiple.
El objetivo del diagnóstico del VEB en las personas inmunosuprimidas es sobre todo la diferenciación entre una infección aguda y una ya pasada. Para ello se utilizan distintos métodos serológicos. El sistema inmune de una persona sana puede limitar rápidamente una reactivación del virus. En los pacientes inmunosuprimidos (p. ej., con tratamiento inmunosupresor tras el trasplante de un órgano o en los casos de infección por VIH), en cambio, el VEB puede propagarse de forma incontrolada y provocar enfermedades linfoproliferativas graves. En algunos casos, es muy importante a nivel diagnóstico determinar también la carga viral, para lo cual en la mayoría de ocasiones se utiliza la PCR
(reacción en cadena de la polimerasa).
Una mononucleosis infecciosa se debe diferenciar a nivel de diagnóstico diferencial de una citomegalia y una toxoplasmosis y, en los casos de evoluciones atípicas, también de una infección por VIH o de otras infecciones.
El VEB puede provocar durante el embarazo una infección de la placenta con daños en el corazón, los ojos y el hígado del feto. Se han estudiado las coinfecciones renales del VEB en niños, que provocan desde microhematuria hasta insuficiencia renal aguda.
La respuesta inmunitaria a una infección por VEB se caracteriza por una respuesta de anticuerpos cronológicamente desfasada contra antígenos de la cápside de VEB (VEB-CA), nucleares del VEB (EBNA) y precoces del VEB (VEB-EA).
En la fase temprana de la enfermedad son detectables anticuerpos IgM e IgG contra el antígeno de la cápside vírica (CA). Un resultado positivo de anticuerpos contra VEB-CA (IgM) es el marcador clásico de una infección aguda. Los anticuerpos IgG contra antígeno precoz aparecen algo más tarde durante la fase aguda y al cabo de entre 3 y 6 meses descienden hasta concentraciones ya no detectables. En cambio, el nivel de anticuerpos IgG contra CA persiste de por vida. Aproximadamente entre seis y ocho semanas después de una infección, se forman anticuerpos contra EBNA. Así pues, su aparición indica una infección ya pasada.
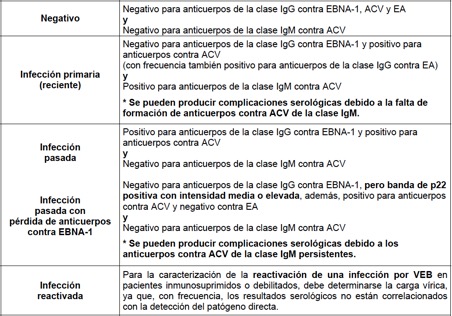
Interpretación de los resultados del Perfil Virus de Epstein Barr
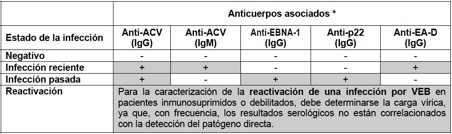
Sinópsis:
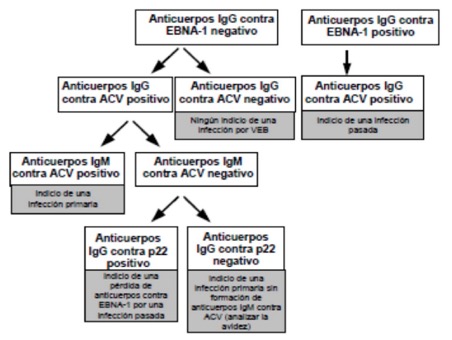
Esquema de interpretación de la serología de VEB:
Referencias bibliográficas
- Ascherio A, Munger KL. 99th Dahlem conference on infection, inflammation and chronic
- inflammatory disorders: Epstein-Barr virus and multiple sclerosis: epidemiological evidence.
- Clin Exp Immunol 160 (2010) 120-124.
- Avgil M, Ornoy A. Herpes simplex virus and Epstein-Barr virus infections in pregnancy: consequences of neonatal or intrauterine infection. Reprod Toxicol 21 (2006) 436-445.
- Bauer G. Simplicity through complexity: immunoblot with recombinant antigens as the new
- gold standard in Epstein-Barr virus serology. Clin Lab 47 (2001) 223-230.
- Bertrand KA, Birmann BM, Chang ET, Spiegelman D, Aster JC, Zhang SM, Laden F. A prospective study of Epstein-Barr virus antibodies and risk of non-Hodgkin lymphoma. Blood 116 (2010) 3547-3553.
- Gärtner B, Hess R, Brandt D, Kruse A, Rethwilm A, Roemer K, Mueller-Lantzsch N. Evaluation of four commercially available Epstein-Barr virus enzyme immunoassays with an immunofluorescence assay as the reference method. Clin Diagn Lab Immunol 10 (2003) 78-82.
- Goldstein BL, Chibnik LB, Karlson EW, Costenbader KH. Epstein-Barr virus serologic abnormalities and risk of rheumatoid arthritis among women. Autoimmunity 45 (2012) 161-168.
- De Paschale M, Clerici P. Serological diagnosis of Epstein-Barr virus infection: Problems and solutions. World J Virol 1 (2012) 31-43.
- Levin LI, Chang ET, Ambinder RF, Lennette ET, Rubertone MV, Mann RB, Borowitz M, Weir EG, Abbondanzo SL, Mueller NE. Atypical prediagnosis Epstein-Barr virus serology restricted to EBV-positive Hodgkin lymphoma. Blood 120 (2012) 3750-3755.
- EUROIMMUN AG. Lipkowski M, Viertel V, Steller U, Fechner K, Korioth S, Stöcker W, Rohwäder E. Monospecific substrates coated with gp125 and p19 antigens can improve the serologic diagnosis of EBV infections by IIFT. International Journal of Medical Microbiology 298S2 (Suppl. 45) 10 (2008).
- Maeda E, Akahane M, Kiryu S, Kato N, Yoshikawa T, Hayashi N, Aoki S, Minami M, Uozaki H, Fukayama M, Ohtomo K. Spectrum of Epstein-Barr virus-related diseases: a pictorial review. Jpn J Radiol 27 (2009) 4-19.
- Mueller NE, Lennette ET, Dupnik K, Birmann BM. Antibody titers against EBNA1 and EBNA2 in relation to Hodgkin lymphoma and history of infectious mononucleosis. Int J Cancer 130 (2012) 2886-2891.
- Pakpoor J, Giovannoni G, Ramagopalan SV. Epstein-Barr virus and multiple sclerosis: association or causation? Expert Rev Neurother 13 (2013) 287-297.






Aún no hay comentarios, ¡añada su voz abajo!